東工大ニュース
東工大ニュース
公開日:2014.12.09
東京工業大学大学院生命理工学研究科の駒田雅之教授と東京都医学総合研究所の田中啓二所長、Medizinische Klinik und Poliklinik IV(メディツィニシェ・クリニック・ウント・ポリクリニックIV研究所、ドイツ)のマーティン・ラインケ所長らの共同研究グループは、クッシング病を引き起こす脳下垂体[注1] の腫瘍の原因遺伝子を発見し、その遺伝子(脱ユビキチン化酵素 USP8[注6] )の変異がクッシング病を引き起こす分子機構を解明した。
クッシング病は厚生労働省の特定疾患および難治性疾患克服研究事業に指定された難病であり、その発症機構はこれまで未解明であった。今回の研究成果は、脳下垂体腫瘍を切除する以外に有効な治療法がなかったクッシング病の治療薬開発に向け大きな一歩となることが期待される。
クッシング病は、脳下垂体[注1] の副腎皮質刺激ホルモン(ACTH)[注2] を産生する細胞の腫瘍により引き起こされる。ACTHは副腎からの糖質コルチコイド[注3] の分泌を促進するペプチドホルモンであるため、クッシング病の患者では脳下垂体の腫瘍細胞から過剰に分泌されたACTHが副腎からの糖質コルチコイドの過剰分泌を誘発する。その結果、満月様顔貌・中心性肥満・糖尿病・高血圧・骨粗鬆症などの合併症を引き起こす(図1)。
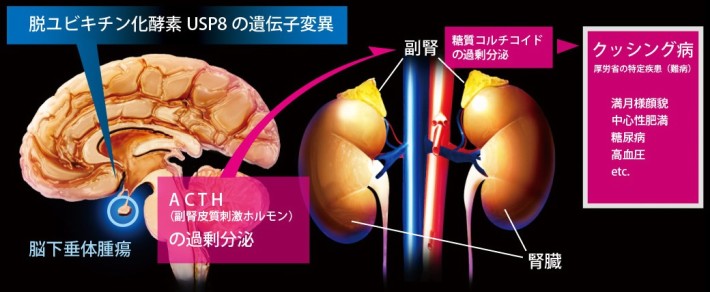
図1. クッシング病の発症機構
クッシング病は治療を行わないと死に至ることもある病であるが、有効な治療薬がなく、完治のための唯一の治療法は脳下垂体腫瘍の外科切除である。しかし、この手術は鼻腔や上歯茎から脳直下に内視鏡を挿入して行う高度な技術を要するものであり、患者にとって特効薬の開発が待ち望まれている。
細胞増殖因子は、細胞表面の受容体タンパク質に結合して受容体を活性化し、様々な細胞応答を誘導する一群の分泌タンパク質である。活性化された受容体は様々なシグナル伝達経路を活性化することで、細胞分裂や遺伝子発現などを引き起こす。同時に、活性化された受容体はすみやかに細胞内に取り込まれ、エンドソームを経由してリソソーム[注4] に運ばれて分解される(図2A)。
これは、活性化された受容体が過度に働くことで細胞の過剰応答を引き起こすことを防ぐための仕組みである(例えば、細胞の過増殖は癌などの腫瘍につながる)。この時、活性化受容体にはユビキチン[注5] というタンパク質が共有結合し、これが多様な細胞膜タンパク質の中から活性化受容体だけを選別してリソソームに運ぶための荷札となる(図2A)。
駒田教授らは、エンドソームで働く脱ユビキチン化酵素 USP8[注6] が活性化された増殖因子受容体からユビキチン(リソソーム行きの荷札)を外して受容体を細胞膜にリサイクルし、その分解を抑制することを明らかにしてきた(図2B)。すなわち、USP8が受容体のユビキチン化レベルを調節してその分解速度を調節することで、活性化受容体から発信される化学シグナルの量を調節していることを解明してきた。
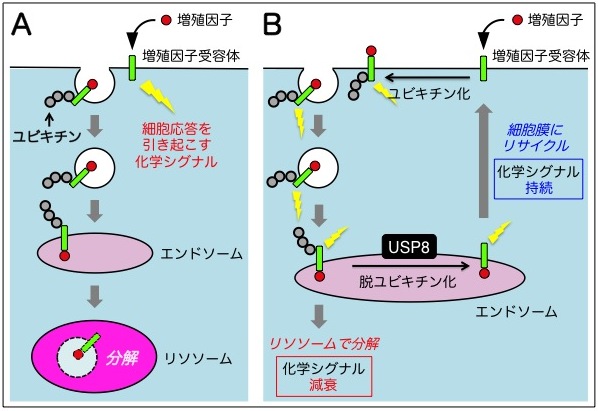
図2. ユビキチン化と脱ユビキチン化による増殖因子受容体の分解調節機構
クッシング病患者から摘出した脳下垂体腫瘍の網羅的ゲノム解析の結果、患者17人中6人(35%)の腫瘍でUSP8にホットスポット変異(1アミノ酸の置換あるいは欠失)が発見された。これらの変異は14-3-3タンパク質[注7] に結合する6アミノ酸配列Arg-Ser-Tyr-Ser-Ser-Proに集中していた。
変異USP8は14-3-3タンパク質結合能を失い、14-3-3結合配列の近傍で未同定のタンパク質分解酵素による切断を受けやすくなっていた。切断されて生じたUSP8断片は脱ユビキチン化酵素活性ドメインのみからなり、高い酵素活性を示した。そして、上皮細胞増殖因子(EGF)で刺激した細胞においてユビキチン化されたEGF受容体を過度に脱ユビキチン化した。
その結果、"リソソーム行きの荷札"を外されたEGF受容体が分解されずに細胞表面にリサイクルされ、EGFのシグナル伝達の下流で働くタンパク質リン酸化酵素Erkの持続的活性化を引き起こしていた。この過剰なEGFシグナルは、ACTH産生細胞の過増殖(腫瘍形成)とペプチドホルモンACTHの過剰産生(遺伝子発現)のいずれか、あるいは両方につながると考えられた(図3)。
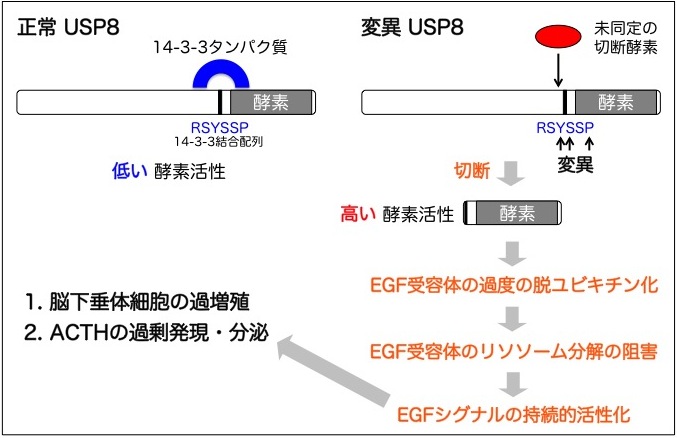
図3. USP8の遺伝子変異がクッシング病を引き起こす分子メカニズム
遺伝子変異によるUSP8の過剰な活性化がクッシング病の原因となるという今回の発見は、USP8の働きを阻害することでクッシング病を治療できる可能性、すなわちUSP8がクッシング病治療薬の分子標的となりうる可能性を提示するものである。これまで存在しなかった有効なクッシング病治療薬の開発に向け、今後USP8阻害剤の探索を加速する必要がある。さらに、変異USP8が特定の部位で切断されて活性化されることが解明されたことから、その切断を阻害することによってもクッシング病を治療できる可能性が示された。そのような阻害剤の開発に向け、USP8を切断する酵素の同定も急務である。
用語説明
[注1] 脳下垂体 : 脳の直下に位置する小指の先ほどの大きさの内分泌器官。副腎皮質刺激ホルモンACTHの他にも甲状腺刺激ホルモン、性腺刺激ホルモン、成長ホルモン、プロラクチンなどを分泌する。
[注2] 副腎皮質刺激ホルモン ACTH : 脳下垂体で前駆体タンパク質プロオピオメラノコルチンとして合成され、限定分解されてACTHとなり分泌される。副腎からの糖質コルチコイドの分泌を促す。
[注3] 糖質コルチコイド : 副腎から分泌されるステロイドホルモン。肝臓における糖新生を亢進し、血糖値を上昇させる。
[注4] リソソーム : タンパク質をはじめ様々な生体高分子を加水分解する約50種類の酵素を含む細胞小器官。増殖因子受容体は細胞表面からエンドソームとよばれる細胞小器官を経由してリソソームに運ばれる。
[注5] ユビキチン : 76アミノ酸からなる小さな細胞内タンパク質。C末端のカルボキシル基を介して様々な細胞内タンパク質のリジン残基にアミド結合で付加され(ユビキチン化)、それらタンパク質の機能を多様な様式で制御する。
[注6] 脱ユビキチン化酵素 USP8 : 脱ユビキチン化酵素は、ユビキチン化されたタンパク質と付加されたユビキチンの間のアミド結合を切断する加水分解酵素の総称。USP8は、ヒトに約90種類存在する脱ユビキチン化酵素の1つ。
[注7] 14-3-3タンパク質 : 様々な細胞内タンパク質に結合し、それらタンパク質の機能を様々に制御する調節タンパク質。
論文情報
掲載誌 : |
Nature Genetics |
論文タイトル : |
Mutations in the deubiquitinase gene USP8 cause Cushing's disease |
著者 : |
Martin Reincke, Silviu Sbiera, Akira Hayakawa, Marily Theodoropoulou, Andrea Osswald, Felix Beuschlein, Thomas Meitinger, Emi Mizuno-Yamasaki, Kohei Kawaguchi, Yasushi Saeki, Keiji Tanaka, Thomas Wieland, Elisabeth Graf, Wolfgang Saeger, Cristina L. Ronchi, Bruno Allolio, Michael Buchfelder, Tim M. Strom, Martin Fassnacht & Masayuki Komada
|
DOI : |
問い合わせ先
大学院生命理工学研究科 生体システム専攻
教授 駒田雅之
Email: makomada@bio.titech.ac.jp
広報センター(プレス担当)
Email: media@jim.titech.ac.jp
TEL: 03-5734-2975 / FAX: 03-5734-3661