分子シャペロン:タンパク質のフォールディングを助けるタンパク質の総称。その多くは熱ショックタンパク質(高温などのストレス時に細胞内のタンパク質が変性するのを防ぐ働きをもつタンパク質ファミリー)である。
東工大ニュース
東工大ニュース
公開日:2012.05.23
東京工業大学大学院生命理工学研究科の田口英樹教授と丹羽達也助教、東京大学大学院新領域創成科学研究科の上田卓也教授らは、細胞内でタンパク質のフォールディング(立体構造形成)を助ける「分子シャペロン」というタンパク質の効果を網羅的に調べ、細胞内でシャペロンが助けるタンパク質のフォールディングの全体像を試験管内で再現しました。
上田教授らが開発した特殊な試験管内タンパク質合成手法(PUREシステム)を利用することで、約800種類もの水に溶けにくいタンパク質のほとんどが2種類のシャペロンのどちらかによって溶けるようになること、3種のシャペロンを同時に作用させるとほぼ全ての溶けにくいタンパク質が溶けるようになることが明らかとなりました。
この実験から得られた大規模データセットは、細胞の中で働くシャペロンタンパク質の作用機構の解明だけでなく、扱いが困難だったタンパク質を扱いやすくする手法の開発にも繋がり、バイオ医薬品開発などにおけるタンパク質の応用利用などにも貢献しうるものです。
この成果は、「米国科学アカデミー紀要」のオンライン速報版で2012年5月21日(米国東部時間)に公開されました。
タンパク質はあらゆる生命の活動を担う生体分子であり、20種類のアミノ酸が様々な並び方で繋がった「ひも」状の物質です。この「ひも」がそれぞれの種類に固有な「かたち(立体構造)」を形成することによって、(折れたたみ、フォールディングと呼ばれます)、機能を発揮します。分子シャペロン(注1)はこの折れたたみを助けるタンパク質であり、生命活動の維持になくてはならない存在です。シャペロンがないと折れたたみができず、タンパク質としての機能を失った「凝集体」と呼ばれる状態になってしまうことが多々あります。
私たちは過去の研究において、大腸菌の全タンパク質(約4,000種類)のうち約800種類が凝集を形成しやすいことを明らかにしました。これらのタンパク質は細胞内ではシャペロンの助けを得ることで固有の「かたち」を取ると考えられますが、実際にどのタンパク質がどのシャペロンの助けを必要とするかは明らかとなっておりません。そこで本研究では大腸菌で働く主要な3種のシャペロンについて、約800個の凝集性タンパク質の凝集形成を解消する効果がどの程度あるかを網羅的に調べ、細胞内でのフォールディングを再現することを試みました。
シャペロンの凝集抑制効果を調べるための実験手法として、過去の研究で用いたPUREシステム(注1)という試験管内タンパク質合成手法を利用しました。通常の試験管内タンパク質合成手法は反応液中に様々なシャペロンを含むため、個別のシャペロンの効果を調べるのに適していませんが、PUREシステムは反応液にシャペロンタンパク質を一切含まないため、効果を調べたいシャペロンを加えることで個々のシャペロンの効果を正確に調べることができます。本研究ではシャペロニン(GroEL)など3種のシャペロンを研究対象として用いました。これら3種のシャペロンを約800種の凝集性の強いタンパク質に対して別々に作用させ、凝集形成がどの程度減少するかを網羅的に調べたところ(図1)、シャペロニンかDnaK(Hsp70)と呼ばれるシャペロンがあると全体の約7割のタンパク質が水に溶けやすくなることがわかりました(図2)。この2種が作用するタンパク質群はその多くが重複していましたが、2種のシャペロンがどのようなタンパク質に作用しやすいかについて詳細な解析を行った結果、分子量や立体構造の特徴などの性質について差がみられました。
さらに、どのシャペロンを加えても水に溶けやすくならなかったタンパク質に対して、複数のシャペロンを加えたところ、ほとんどのタンパク質が水に溶けやすくなりました(図3)。この結果はこれらのシャペロンが協同してタンパク質の凝集抑制効果を発揮していることを反映しており、細胞内でのフォールディングを試験管内で再現したと言えます。
この実験で得られたデータセット(約800個×3種のシャペロンの効果)は、シャペロンの作用機構の詳細な解析や、タンパク質一般に広く通用する凝集になりやすいタンパク質の可溶化手法の確立に向けた研究に役立つことが期待されます。タンパク質の可溶化法の一般則が見いだされれば、抗体医薬などの創薬やタンパク質の工業的利用などの分野に非常に有用な知見となります。
本研究で得られたデータセットはパブリックデータベースとして一般に公開されており、大学、企業を問わずタンパク質を用いた基礎研究・応用研究に広く利用されることが期待されます。データベースの名称:eSOLデータベース
http://www.tanpaku.org/tp-esol/
(Google検索で「eSOL、データベース」で検索可能です)
eSOLデータベースは国立遺伝学研究所の菅原秀明教授らによって作成、運営されています。
用語説明
分子シャペロン:タンパク質のフォールディングを助けるタンパク質の総称。その多くは熱ショックタンパク質(高温などのストレス時に細胞内のタンパク質が変性するのを防ぐ働きをもつタンパク質ファミリー)である。
PUREシステム:大腸菌のタンパク質合成に必須の因子だけからなる試験管内タンパク質合成手法。シャペロンを含まない。
問い合わせ先
田口 英樹
東京工業大学 大学院生命理工学研究科 生体分子機能工学専攻 教授
電話/FAX:045-924-5785
上田 卓也
東京大学 大学院新領域創成科学研究科 メディカルゲノム専攻 教授
電話:04-7136-3641
FAX:04-7136-3642
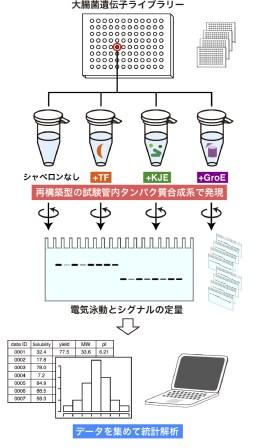
図1 実験手法の模式図
大腸菌の遺伝子ライブラリー、再構築型試験管内タンパク質合成手法(PUREシステム)を用いてタンパク質を1つずつ合成させ、遠心分離と電気泳動によってタンパク質の水への溶けやすさを算出。この操作を約800個の不溶性タンパク質に対して4条件(シャペロンなしとシャペロン3種)ずつ行い、得られた結果とタンパク質の性質などを統計処理によって比較・解析する。使用したシャペロンの種類は、TF: トリガー因子、KJE: DnaKシャペロン系、GroE: シャペロニン系。
図2 3種のシャペロン単独添加での凝集抑制効果のヒストグラム
横軸に示したタンパク質の可溶の度合いが大きいほど凝集が解消されたことを意味する。DnaK系とGroEL/ES(シャペロニン系)を加えた条件では分布が右側に移動しており、多くのタンパク質が溶けやすくなったことが確認できる。
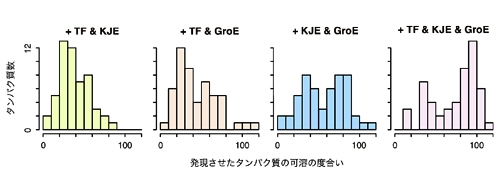
図3 複数種類のシャペロンを用いた際の凝集抑制効果のヒストグラム
横軸の値は図2と同じ意味を持つ。KJE(DnaK系)とGroE(シャペロニン系)の両方を加えると可溶の度合いが高いものが多くなり、TF(トリガー因子)をさらに含めた3種全てを加えるとさらに分布が右側に移動していることが確認できる。
本件に関するお問い合せ先
田口 英樹
大学院生命理工学研究科 生体分子機能工学専攻 教授
電話: 045-924-5785
FAX: 045-924-5785
E-mail: taguchi@bio.titech.ac.jp