東工大ニュース
東工大ニュース
公開日:2012.06.18
本学資源化学研究所の田中寛教授と千葉大学大学院園芸学研究科の華岡光正特任准教授らの研究グループは、名古屋大学大学院理学研究科の近藤孝男教授、早稲田大学理工学術院の岩崎秀雄教授らと共同で、光合成微生物であるシアノバクテリアを用いて、概日時計(サーカディアンクロック)が生み出す時間情報を24時間周期で変動する遺伝子発現リズムに伝える分子機構の詳細を世界で初めて解明しました。
本学資源化学研究所の田中寛教授と千葉大学大学院園芸学研究科の華岡光正特任准教授らの研究グループは、名古屋大学大学院理学研究科の近藤孝男教授、早稲田大学理工学術院の岩崎秀雄教授らと共同で、光合成微生物であるシアノバクテリアを用いて、概日時計(サーカディアンクロック)が生み出す時間情報を24時間周期で変動する遺伝子発現リズムに伝える分子機構の詳細を世界で初めて解明しました。
これまでに、シアノバクテリアの概日時計はKaiA、KaiB、KaiCと呼ばれる3種類のタンパク質から構成されること、また、その時間情報はSasAとRpaAからなる二成分制御系を介して下流の遺伝子発現リズムに伝達されることが分かっていました。研究グループは、転写因子としての機能が予想されていたRpaAタンパク質に加えて、そのホモログであるRpaBタンパク質が重要な役割を果たすことを新たに見いだしました。
RpaAは転写の活性化に関わる正の転写因子として機能することがこれまでの遺伝学的解析より示されていましたが、ターゲット遺伝子のプロモーター領域への直接的な結合は実験的に証明されていませんでした。一方で、そのホモログであるRpaBは、これまで強光ストレス応答に関わる転写制御因子であることが報告されていましたが、本研究により、概日時計に依存した転写制御にも深く関わることが新たに明らかにされました。RpaBは、約24時間周期で発現する遺伝子のプロモーター領域に夜間に特異的に結合すること、また結合することによって転写を抑制する負の制御因子として機能することが示されました。
このことから、RpaAとRpaBがそれぞれ正と負の転写調節因子として協調的に働くことで、24時間周期のゲノムワイドな遺伝子発現リズムが生み出されることが示唆されました。
これらの成果は、細胞の中で形成される時間情報を正確に代謝機能や細胞増殖のために伝達するための仕組みの解明であり、生物時計の基本機構を産業に活かす医学・農学分野への応用展開や、24時間周期の生体分子スイッチの開発など、合成生物学分野への応用も期待できます。
本研究成果は、米国科学雑誌「The Journal of Biological Chemistry」の平成24年8月号(予定)に掲載されるに先立ち、オンライン版が論文の受理と同時に公開されています。
地球の自転により生じる昼夜の明暗サイクルは、多くの生物にとって非常に大きな環境変動と言えます。生物がその時間を知りあらかじめプログラムされたサイクルで代謝など様々な生体機能をコントロールすることは、効率のよい生命活動を営む上でたいへん重要と考えられます。概日時計は、様々な生命現象を約24時間周期で維持するための内的なシステムであり、我々ヒトを含め幅広い生物種で見出されています。本研究の材料として用いたシアノバクテリアは、酸素発生型の光合成を行う原核生物(バクテリア)であり、全ての植物の葉緑体の共通祖先と考えられています。シアノバクテリアの概日時計の中心振動体は、KaiA、KaiB、KaiC と呼ばれる3種のタンパク質のみにより構成されることが知られています。また、この振動子が生み出す時間情報は、ゲノム全遺伝子の1/4に及ぶ約700の遺伝子発現リズムに出力されることが示されています。周期的に発現するこれら高振幅遺伝子の転写は、ヒスチジンキナーゼSasAと、レスポンスレギュレーターRpaAから構成される二成分制御系を介した調節を受けることが知られていましたが、出力系の詳細なメカニズム、つまり、どのようなメカニズムで24時間周期の遺伝子発現リズムが生成されるかについての「時計の針の動き」に関する実体はこれまで謎とされてきました。
本研究では、SasA-RpaAからなる二成分制御系がどのように周期的に発現する遺伝子の転写制御に関わるかを明らかにすることを目指し研究を開始しました。まず、ゲルシフト法、クロマチン免疫沈降法と呼ばれるDNA-タンパク質間の結合を検出する方法を用いて、ターゲット遺伝子へのRpaAの結合について調べました。しかし、試したどのような条件においてもRpaAとDNA間の明確な結合は認められませんでした。そのため、24時間周期を生み出す転写制御においては、RpaAだけではなく、何か別の制御因子がRpaAと協調的に機能している可能性が考えられました。その候補として挙がった因子がRpaAのホモログであるRpaBでした。RpaBはシアノバクテリアの光合成機能を強光ストレスから守るために働くことがこれまでの研究で報告されていましたが、概日時計の出力系で機能することは全く示されていませんでした。
同様の解析手法によってRpaBとターゲット遺伝子プロモーター間の結合を調べた結果、時計遺伝子kaiBCのプロモーター領域に特異的に結合するのはRpaAではなくRpaBであることを世界で初めて突き止めました。また、4時間ごとの連続的なサンプリングを行い、1日の様々な時間帯におけるRpaAとRpaBの結合パターンを詳細に調べたところ、夜間に特異的に見られるRpaBの結合は、朝方から昼間にかけて徐々に弱まり、夜間になると再び強く結合した状態に戻るという周期的な結合パターンを示しました(図1)。この24時間周期の結合パターンは、kaiBCなどターゲット遺伝子のmRNAの発現パターンとちょうど逆相関の動きを示す(RpaBが結合していると転写が抑制され、RpaBが外れることにより転写が活性化される)ことから、RpaBは負の転写因子として機能することが示されました(図1)。一方で、RpaAは何れの時間においても結合が認められず、DNAに結合しない形で転写制御に関与していることが示唆されました(図1)。
RpaAとRpaBによる協調的な転写調節機構をさらに明らかにするために、両者を同時に加えた際にどのように結合パターンが変動するかを調べました。RpaBがDNAに特異的に結合することはすでに述べましたが、この状態でRpaAを徐々に加えた結果、RpaBによる結合が失われることが分かりました。すなわち、夜間にRpaBの結合により抑制されていた転写を、朝方~昼間にかけてRpaAが解除している可能性が強く示唆されました(図2)。
このようにして、RpaAとRpaBがそれぞれ正・負の転写因子として協調的に働くことで、時計の振動中心から得られた時間情報を正確にゲノム全体の遺伝子発現リズムに伝達しているものと予想されました。また、このシステムの下流にはRNAポリメラーゼの調節サブユニットであるシグマ因子の遺伝子群も含まれており、RpaAとRpaBによって出力された時間情報は、これらシグマ因子を介してゲノム全体の約1/4にも及ぶ多くの遺伝子群の転写振動に増幅されていると考えられました(図2)。
真核生物の概日時計は、これまで動物・植物を問わず転写翻訳のフィードバック制御が重要な役割を果たすことが示されてきました。つい最近になって、遺伝子発現を介さない振動体の存在を示唆する結果が報告され大きな話題となりまたが、それでも中心振動体の実体については現在もまだ明らかにはされていません。一方で、原核生物であるシアノバクテリアにおいては、中心振動体がKaiA、KaiB、KaiCの3つのタンパク質のみから構成されること、そのうちKaiCのリン酸化リズムが約24時間の周期を決定する上で重要であることが示されてきました。しかし、この中心振動体とゲノムワイドな遺伝子発現リズムをつなぐ出力系の詳細は謎のままでした。本研究では、全ての生物で初めて、両者をつなぐ直接的、かつ完全なループの解明に至ったと言えます。
植物や微生物の光合成機能は、環境問題、食糧問題を解決するための「グリーン・イノベーション」として最近特に注目されています。光合成機能をうまく利活用するためには、これら光合成生物の持つ環境適応機構を理解することが必要不可欠であると言えます。概日時計機構は、光合成をはじめ様々な代謝機能を最適化するために生物が備えた究極的な体から転写リズムを介して再び時計タンパク質に至る全体像を解明することができました。
この成果は、将来、概日時計のシステムを利用して光合成能や生産性を向上させるなどの応用研究に展開する上での大きな手がかりとなり、農学分野における実用化への道が拓かれたと同時に、概日時計機構は動物にも広く見いだされることから、医学・薬学分野への応用も期待できます。さらに、正と負の転写因子が協調的に機能することで24時間周期の遺伝子発現が生み出されることから、この時計の仕組みを分子スイッチの設計などに利用する合成生物学分野への応用も期待されます。
‘RpaB, another response regulator operating circadian clock-dependent transcriptional regulation in Synechococcus elongatus PCC 7942’ (Synechococcus elongatus PCC 7942
において概日時計に依存した転写制御を調節するもう一つのレスポンスレギュレーターRpaB)
The Journal of Biological Chemistry, Papers in Press (doi:10.1074/jbc.M111.338251)
http://www.jbc.org/content/early/2012/06/04/jbc.M111.338251.long
Mitsumasa Hanaoka, Naoki Takai, Norimune Hosokawa, Masayuki Fujiwara, Yuki Akimoto, Nami Kobori, Hideo Iwasaki, Takao Kondo, and Kan Tanaka
(華岡光正、高井直樹、細川徳宗、藤原正幸、秋元勇輝、小堀奈美、岩崎秀雄、近藤孝男、田中寛)
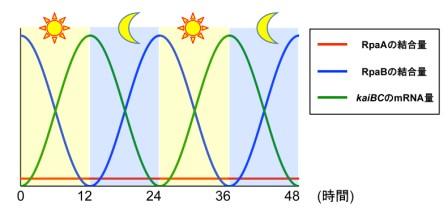
図1 1日24時間周期におけるRpaA、RpaBの結合パターンの変化
RpaBは夜間にターゲット遺伝子のプロモーターに強く結合しており、夜明けから昼間にかけてその結合が弱まる。kaiBCなどのターゲット遺伝子のmRNA量は、RpaBの結合と逆相関を示しており、RpaBは結合することで転写を抑制する負の転写因子であることが示唆された。また、RpaAは何れの時間帯においても結合が認められなかった。
システムと捉えることができます。今回の研究により、シアノバクテリアの細胞が24時間周期のリズムを遺伝子発現レベルで生成するメカニズムが明らかになり、時計の中心振動
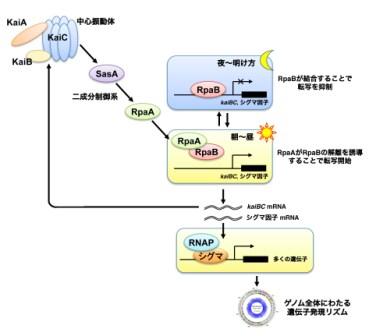
図2 RpaAとRpaBによる概日時計に依存した協調的な転写調節のモデル
KaiA,B,Cで構成される中心振動体からの時間情報は、二成分制御系SasA-RpaAによって伝達されるが、単にRpaAによって転写が誘導されるのではなく、夜間のRpaBの結合による転写抑制をRpaAが解除することで転写を活性化することが分かった。また、RpaA/BはRNAポリメラーゼ(RNAP)のサブユニットであるシグマ因子の転写を調節しており、このシグマ因子により多くの遺伝子の周期的な転写リズムが生じるものと考えられた。
本件に関するお問い合せ先
田中 寛
資源化学研究所 教授
電話: 045-924-5274
FAX: 045-924-5274
E-mail: kntanaka@res.titech.ac.jp