東工大ニュース
東工大ニュース
公開日:2014.12.03
東京工業大学資源化学研究所の久堀徹教授と原怜特任助教は、生体内のタンパク質の機能・構造に重要なシステイン[用語1] の状態を簡単かつ定量的に検出できる新ツール(標識化合物)「DNA-PCマレイミド」を開発した。この化合物を付加(修飾)したタンパク質を電気泳動[用語2] で調べると、明確な移動度の差が得られる。また紫外線でDNAを切断可能なため、抗体色素法[用語3] で、生体内のタンパク質の酸化還元状態などを可視化でき、タンパク質の状態解析の応用範囲を大きく広げることになる。
近年、生体内で働く酵素タンパク質の酸化還元状態が、その生理機能を決定する重要な因子となっている。特にタンパク質を構成するアミノ酸の一つであるシステインは、酸化還元の影響を受けやすく、かつタンパク質構造の決定に重要な分子内の共有結合の足場にもなっていることから、その状態を知ることがタンパク質機能やその調節を明らかにする上で重要な情報となっている。
久堀教授らは昨年、システインの状態を探るツールとして、DNAを化学修飾剤として用いる「DNAマレイミド」という化合物を開発した。この化合物は、還元状態のシステインにだけ反応してタンパク質の分子量を一定量変化させることができるので、変化量からシステインの状態を正確に知ることができる。しかし、DNAのような高分子が付いているため、抗体染色法には使えなかった。今回はこの欠点を紫外線照射によってDNA部分を容易に除去できる方法で解決し、抗体染色にも使用できるようにした。
タンパク質分子を構成する20種類のアミノ酸のうち、システインのチオール基(SH基)[用語4] は、酸化によってスルフェン(SOH)やスルフィン(SOOH)になる、グルタチオン化やS-ニトロソ化されるなど、生体内で様々な化学修飾を受けている。近年、タンパク質分子のシステインが受けるこのような化学修飾が、そのタンパク質の生理機能の調節に重要な役割を果たしていることが明らかになってきた。
また、システインのチオール基は適当な距離に二つ存在すると、酸化条件下でジスルフィド結合[用語5] という共有結合を形成し、これがそのタンパク質の立体構造を決定する重要な要因にもなっている(図1)。システインの化学修飾やジスルフィド結合の形成は、生体内では生理条件下で起こっているため、この状態変化を知ることは、タンパク質の機能そのものや機能調節を理解する上で重要な情報である。
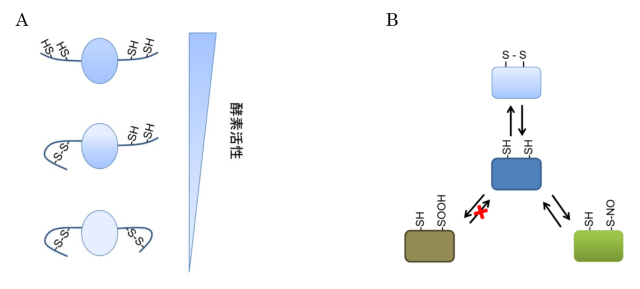
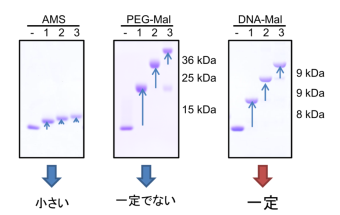
これまで、システインのチオール基の状態を探るツールとして、システインと特異的に反応するマレイミド[用語6] をもつ化合物が用いられてきた。例えば、4-acetamido-4'-maleimidylstilbene(4−アセトアミド−4'−マレイミジルスチルベン=AMS)は、分子量540ほどでチオール基と特異的に反応し、タンパク質全体の分子量を約500大きくするので、この変化を電気泳動時のタンパク質の移動度変化として検出することが可能である。
しかし、分子量が3万を超えるタンパク質の場合には、タンパク質そのものの分子量に比べて移動度の変化の割合が小さすぎて検出が困難であった。この問題を克服するために、methoxypolyethylene glycol-maleimide(メトキシポリエチレングリコール・マレイミド=PEG マレイミド、通常使われるものは分子量約5,000)が用いられるが、PEG 分の化学的な性質の制約から、電気泳動時に付加した分子量に見合った移動度の変化を示さないので、移動度の変化量から反応したシステインの数を知ることができなかった。
AMSやPEGマレイミドのこれらの欠点を克服するために、久堀教授らはDNAを修飾剤として用いることにして、昨年、DNAマレイミドという化合物を開発した。使用したのは24塩基の一本鎖DNAで、システインを修飾すると結合DNAの数の分だけ電気泳動の移動度を変化させることができる。結合したDNAあたりの移動度変化が分かっているので、タンパク質分子の中で還元状態にあるシステインのチオール基を、電気泳動の移動度変化から逆算して簡単に見積もることができるようになった(図2)。
久堀教授らが開発したDNAマレイミドは、簡便にタンパク質のチオール基の酸化還元状態を知ることのできるツールではあるが、高分子量の化合物をタンパク質に付加するために起こる特有の問題があった。それは、生体内のタンパク質の検出によく用いられる抗体染色法に利用できないことである。
抗体染色法は、電気泳動によって分離したタンパク質分子を、抗体染色法に用いるニトロセルロース膜などに電気泳動的に移動(転写という)させてから、膜表面で目的タンパク質と抗体と反応させる。ところが、DNAのような高分子を付加したタンパク質は、この高分子部分がおそらく邪魔をしてタンパク質が抗体染色用の膜の方に移動していかないことが分かった。
そこで、DNAマレイミド分子のDNA部分とチオール基修飾部分であるマレイミド部分の間に光開裂基を導入して、紫外線照射によってタンパク質のチオール基に結合したDNAが離脱するように工夫した。この新規に作成した化学修飾試薬を、光開裂型(Photo-Cleavable)の頭文字を取って「DNA-PCマレイミド」と命名した。
DNA-PCマレイミドは、これまでのDNAマレイミドと同じようにタンパク質のチオール基を修飾し、分子量変化を与えることができる。一方で、電気泳動後にゲルを紫外線ランプの上に10分程度放置するだけで光開裂反応が起こり、DNA部分がタンパク質から簡単に離脱する。タンパク質の電気泳動後にゲルを紫外線処理してから、抗体染色用の膜へのタンパク質の転写処理を行うと、DNAマレイミドで修飾していないタンパク質と同じ効率でタンパク質が抗体染色用の膜に転写するようになった。
実用例として、HeLa細胞[用語7] を酸化剤、あるいは還元剤で処理した後に、細胞からタンパク質を抽出し、すみやかに DNA-PC マレイミドで化学修飾を施した。そして、抗体染色法を用いて特定のタンパク質の酸化還元状態を調べた。ここでは、分子内にシステインを3個持っているグリセルアルデヒド 3-リン酸脱水素酵素(GAPDH)の状態変化を調べた。
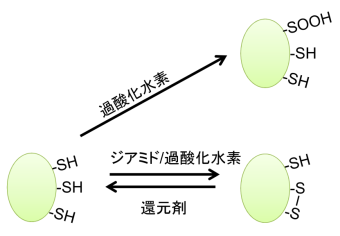
細胞をジアミドによって酸化処理してから GAPDH の状態を見ると、酸化されたチオール基が2個となり、これを還元処理することですべて還元状態に戻ることがわかった。すなわち、ジアミドによる酸化処理で、GAPDH分子にジスルフィド結合が形成されたことが分かる。
一方、細胞を過酸化水素で処理した場合には、酸化されたチオール基を1個もつタンパク質と2個もつタンパク質が得られた。これを還元処理したところ、2個が酸化された状態のタンパク質のチオール基はすべて還元状態に戻ったが、1個が酸化されたものでは、変化が見られなかった。すなわち、後者のチオール基はスルフィンのように容易には還元されない状態になっていることがわかった(図3)。
また、抗体染色法はシグナル強度でタンパク質量も見積もることができるので、細胞内のGAPDHがどのくらいの割合でジスルフィド結合を形成したり、スルフィンに酸化されたりしているのかも見積もることが可能になった。
近年、プロテオミクス技術[用語8] 、および、質量分析法[用語9] が急速に進歩し、タンパク質の状態変化はその構成アミノ酸の状態変化として詳細に記述することができるようになってきた。しかし、網羅的な解析を行うためには、状態の変化が見られるタンパク質を迅速に検出するためのツールの開発が不可欠である。
今回、開発したDNA-PCマレイミドは、生体内のタンパク質の機能・構造に重要なシステインの側鎖・チオール基の状態を簡単に、かつ、定量的に検出できるツールであり、応用範囲は極めて広い。この方法で検出したチオール基の変化は、さらに質量分析法によって個々のアミノ酸レベルでの変化の解析に用いるための重要な情報となるはずであり、細胞内のタンパク質の酸化還元状態を網羅的に解析するレドックス・プロテオミクス[用語10] の重要なツールのひとつとなるものと期待される。
久堀教授らが開発したDNA-マレイミド、および、DNA-PCマレイミドは特許化し、12月に株式会社同仁化学研究所から発売される。
本研究は、久堀教授が代表を務める科学技術振興機構(JST)CREST「ハイパーシアノバクテリアの光合成を利用した含窒素化合物生産技術の開発」、および、附置研究所間アライアンスによる「ナノとマクロをつなぐ物質・デバイス・システム創製戦略プロジェクト」の支援を受けて実施した。
用語説明
[用語1] システイン : 生体内のタンパク質を構成する20種類のアミノ酸のひとつで、側鎖に反応性の高いチオール基(SH基)を持っている。
[用語2] 電気泳動 : 生体高分子の持つ固有の電荷の総和の違いを利用して、一定の電場の中で生体高分子を分離する技術。タンパク質や核酸を分離するのに用いる。
[用語3] 抗体染色法 : 特定のタンパク質(抗原)に反応する抗体を用いて、電気泳動で分離したタンパク質を検出する技術。電気泳動ゲル中で分離されたタンパク質をニトロセルロースなどの高分子膜に写し取り、その膜表面で抗原抗体反応を起こさせる。特定タンパク質に結合した抗体は、さらにその抗体に特異的に反応する抗体(発色機能を持たせてある)で識別し、可視化することが出来る。
[用語4] チオール基 : その分子式からSH基と省略されるが、反応性が高く簡単に酸化されジスフィド結合を形成する。酵素の活性中心や構造形成に重要な場所に見られ、酵素の機能に密接に関わっている。
[用語5] ジスルフィド結合 : 二つのチオール基が酸化されることで形成される共有結合のこと。タンパク質の構造を規定する重要な結合になっている場合が多い。ひとつの分子の中で形成される場合には分子内ジスルフィド結合、二つの分子間で形成される場合には分子間ジスルフィド結合という。S-S 結合と略される。
[用語6] マレイミド : マレイン酸がイミド化(環状化したイミノ基(NH)を持つ状態)したものをよぶ。
[用語7] HeLa細胞 : ヒト由来の培養細胞。ヒト細胞のモデルとして一般的に使われている細胞である。
[用語8] プロテオミクス技術 : 生体を構成する複数のタンパク質を網羅的に解析する技術の総称である。
[用語9] 質量分析 : タンパク質の質量分析では、プロテアーゼ等で断片化されたペプチドの分子量を正確に測定する。これによって、ペプチドを構成するアミノ酸の同定や、側鎖の化学修飾を解明できる。
[用語10] レドックス・プロテオミクス : タンパク質は酸化還元状態(レドックス状態)の変化によって機能調節されている場合が多い。どのようなタンパク質が酸化還元状態に応じてどのように化学修飾されているのかを網羅的に解析する手法である。
論文情報
掲載誌 : |
Biochemical and Biophysical Research Communications |
論文タイトル : |
Direct determination of the redox status of cysteine residues in proteins in vivo |
著者 : |
Satoshi Hara, Yuki Tatenaka, Yuya Ohuchi, Toru Hisabori
|
DOI : |
参考文献
掲載誌 : |
Biochim Biophys Acta. 2013 Apr;1830(4):3077-81. |
論文タイトル : |
DNA-maleimide: an improved maleimide compound for electrophoresis-based titration of reactive thiols in a specific protein. |
著者 : |
Hara S, Nojima T, Seio K, Yoshida M, Hisabori T.
|
DOI : |
問い合わせ先
東京工業大学 資源化学研究所附属 資源循環研究施設
教授 久堀徹
Email: thisabor@res.titech.ac.jp
東京工業大学 資源化学研究所附属 資源循環研究施設
特任助教 原怜
Email: hara.s.ab@m.titech.ac.jp
TEL: 045-924-5234 / FAX: 045-924-5268