東工大ニュース
東工大ニュース
公開日:2017.08.08
免疫細胞を活性化する情報伝達分子の働きを解明
―生きた細胞中の1分子の動きと相互作用を見る新手法を開発―
東京工業大学 生命理工学院の伊藤由馬特任助教、十川久美子准教授、徳永万喜洋教授の研究チームは、新しい分子動態解析方法を開発。免疫T細胞の活性化を開始させる分子メカニズムを定量的に明らかにしました。
免疫システムの司令塔として働くリンパ球T細胞が休止状態から働くようになる際には、細胞表面で抗原を受容したという情報を伝える分子が集まることにより細胞活性化が始まることが知られています。
このような生命の働きが、分子のどのような動きや変化、分子間相互作用によって実現されているのかは、いまだに謎が多い。これらを明らかにする生命動態の分野が、ライフサイエンスにおける世界的な大きな潮流となっています。ここでは、光学顕微鏡で分子1個1個を直接観る1分子イメージング法が、重要な方法となっています。これまで、1分子イメージング法で、分子の動きの時間的な変化や、分子間相互作用を定量的に計測する良い手法がありませんでした。
今回、研究チームは、分子1個1個の軌跡を追跡し、分子の動きばかりでなく、他の分子との相互作用も、時間的・空間的な変化を解析できる新しい方法を考案し、定量計測を実現しました。
この方法を使って、免疫T細胞の情報伝達分子が2段階で活性化されること、分子集合体の周囲で活性化が調整されていることを明らかにしました。
今回考案された方法は、基本的な手法として、今後広く用いられ、多くの生命機能の分子メカニズム解明に大きな成果をもたらすことが期待されます。
本研究成果は、英国のオンライン科学雑誌『Scientific Reports』(8月1日付け:日本時間8月1日)に掲載されました。
近年、生きている細胞内での分子を直接観察する分子イメージング技術の進歩により、生命の仕組みを分子のダイナミックな動きや分子間の相互作用として明らかにする、分子動態[用語1]の分野がライフサイエンスにおける世界的な大きな潮流となっています。2008年のノーベル化学賞「緑色蛍光タンパク質 GFPの発見と開発(下村脩博士他)」、2014年のノーベル化学賞「超解像顕微鏡の開発」の受賞に端的に示されています。
さらにこの分野は、ゲノム解析以降の種々の配列情報研究の長足の進歩を相補するものとして、一層重要性を増しています。データ科学やシステムズバイオロジー[用語2]の進歩により、分子の動きや相互作用を定量的に計測し、数値情報として解明することが求められています。
免疫細胞は、体を外敵から防御する免疫系として中心的な役割を担っています。病原菌・ウィルスや花粉などの異物が体内に侵入したことを察知すると、樹状細胞などの抗原提示細胞がそれらを取込み、抗原として細胞表面に提示します。リンパ球の一種であるT細胞は、提示された抗原を認識すると、一連の細胞内シグナル伝達系が働くことで細胞が活性化し、免疫系を活性化する司令塔としての役割を果たします。
研究チームは以前に、蛍光[用語3]を使って分子1個1個を光学顕微鏡で直接観察できる1分子イメージング顕微鏡の方法として、対物レンズ型全反射照明(TIRF)法[用語4]や薄層斜光照明(HILO照明)法[用語5]を開発しています。
また、これらの顕微鏡法を使って、抗原を認識するT細胞受容体が核となって種々のシグナル伝達分子が数十~数百分子集合して「マイクロクラスター[用語6]」と呼ばれる集合体を形成することが、T細胞活性化の開始点であることを明らかにしています。T細胞活性化の仕組みの解明は、免疫制御に関するバイオ医薬品などの新しい展開に伴い、臨床応用においても一層の重要性を増しています。
T細胞が、提示された抗原を認識するのは、T細胞膜表面のT細胞受容体(TCR)分子とCD3分子とからなるT細胞受容体複合体(TCR/CD3)が抗体と結合することから始まります。抗体とTCR/CD3複合体とが結合すると、CD3がリン酸化[用語7]されて活性化された状態になります。この活性化反応は、細胞膜にあるリン酸化酵素[用語7]であるCD45分子により制御されています。CD45は、活性化するばかりでなく、活性化を抑制する働きも持っており、精巧な免疫システムに重要な役割を果たしています。研究グループは、T細胞活性化の開始の仕組みを明らかにするために、CD3とCD45に注目しました。
研究グループが独自に開発した1分子イメージング顕微鏡を用いて、CD3分子、CD45分子、マイクロクラスターを生きた細胞の中で同時に1個1個鮮明に観察しました(図1、2)。平面上の人工の細胞膜[用語8]の上で細胞を活性化しているので、細胞内での本来の動きが観察されます。
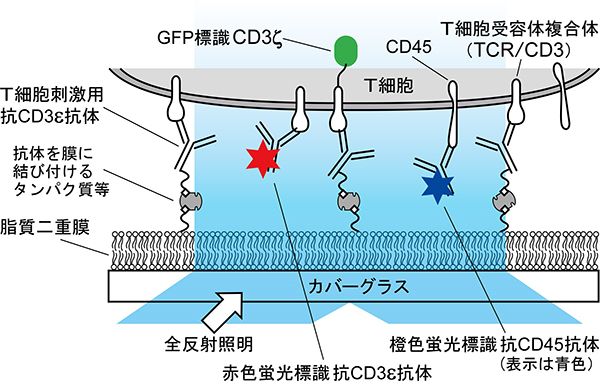
図1. T細胞活性化のシグナル伝達分子動態を可視化するための観察方法
本研究では、抗原提示細胞の代替として人工の細胞膜(脂質二重膜)を用いた。脂質二重膜に結合させた細胞刺激用の抗CD3ε抗体(CD3εはCD3を構成するサブユニットの一つ)により、T細胞の細胞膜にあるT細胞受容体複合体(TCR/CD3)が数十~数百分子集まりマイクロクラスターを形成し、T細胞を活性化させる。この活性化反応は、膜タンパク質であるリン酸化酵素CD45分子により制御されている。脂質二重膜を用いることにより、シグナル伝達活性化における分子の動きを、細胞本来のまま観察できる。マイクロクラスターは、緑色蛍光タンパク質GFPをつなげたCD3ζ(CD3ζはCD3を構成する別のサブユニット)により可視化した。CD45およびCD3は、橙色蛍光標識した抗CD45抗体(青色で図示)と赤色蛍光標識した抗CD3ε抗体により、個々の1分子を可視化。全反射照明法を用いており、鮮明な画像が得られる。
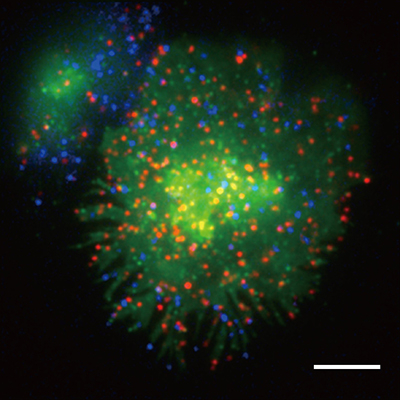
図2. 3色同時1分子イメージング蛍光顕微鏡画像
個々の点はそれぞれ、青色:CD45 1分子、赤色:CD3 1分子、緑色:T細胞受容体マイクロクラスター1個。バーは5 μm(ミクロン)。動画として録画されたものの、ある時刻での画像。なお、CD45は橙色の蛍光で標識されているが、画像は識別のために青色で表示している。
得られた動画中の分子1個1個の位置を正確に求め、時間とともに動いてゆく様子を、軌跡として追跡します(図3)。従来の解析方法では、1つの軌跡の全ての点を一度に使うので、1つの軌跡から1個のデータしかとれず、また、途中で動き方が変化するために正確な数値が求められませんでした。

図3. 1分子軌跡追跡の例
マイクロクラスターの画像(白黒、白がマイクロクラスター)の上に、CD45(青)とCD3(赤)1分子の軌跡を重ねてある。軌跡の各点は、動画フレーム間隔(33.33 ms)の時間ごとでの分子位置を示す。矢印は、軌跡がマイクロクラスター内に入っている部分を示す。バーは1 μm。
今回新しく開発した方法(移動部分軌跡解析、moving subtrajectory analysis)では、軌跡の一部(部分軌跡、subtrajectory、図4の例では11点)のみを使って動きに関する数値(拡散係数[用語9]など)を求め、さらに、部分軌跡を1点ずつずらしながら解析を繰り返します。これにより正確にかつ多くのデータが得られます。
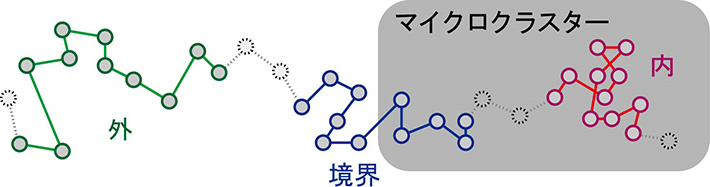
図4. 今回開発した移動部分軌跡解析(moving subtrajectory analysis)法の模式図
軌跡の一部(部分軌跡、この例では11点)のみを使って動きを解析する。さらに、部分軌跡を1点ずつずらしてゆきながら解析を繰り返す。こうすることで、時間的な変化が追えるとともに、場所(この例ではマイクロクラスター内・境界・外)による違いも数値として明らかにできる。
この新しい解析方法により、分子の動きが、時間や場所によりどのように変化してゆくかを、数値情報として追うことが初めて可能となりました。そればかりでなく、分子が他の分子と結合する速さと解離する速さとを1分子の動きのみから求めることが初めて実現しました。
この解析を用いて、次のことがわかりました。
このような分子動態と相互作用の詳細を定量的に明らかにしたことは、生命の仕組みの分子メカニズムを解明する上で、画期的な成果と言えます。
今回考案された方法は、分子動態と相互作用を定量的に解明する基本的な手法として、今後広く用いられると考えられます。
また、細胞表面での反応に限らず、生きた状態の細胞内部での仕組みにも用いることができます。免疫細胞に限らず、例えば、核内で遺伝子が発現する時にどのようなことが起こっているのかなど、種々の生命機能に適用できます。この手法で、生命現象の分子メカニズム解明に大きな成果をもたらすことが期待されます。
用語説明
[用語1] 分子動態 : 分子の動きや分子間の相互作用を、可視化したり定量的に計測して明らかにすること。
[用語2] システムズバイオロジー : 生命の仕組みをシステムとして統合的に理解することを目的とした研究分野。計算機によるシミュレーションにより生命現象を明らかにする研究が進められている。多種多数の生体分子の、空間的な配置、時間的な変化、多種分子間の反応や結合等に関して、生きた細胞や生体の中での数値情報を得ることが重要となっている。
[用語3] 蛍光 : 照明した光とは色(波長)の異なる光を出す現象のこと、もしくは出された光。蛍光を発する色素(蛍光色素)を用いて、観察対象を標識して見る顕微鏡法が蛍光顕微鏡法である。色の違いを利用して、標識した観察対象から出た蛍光のみを選び観察することができるので、背景光をカットして微弱にし、見たいもののみを鮮明に見ることができる。※名前が誤解をしばしば招くが、生物の蛍が光るのは生物発光によるもので蛍光現象とは異なる。
[用語4] 全反射照明(TIRF)法 : 試料と基板ガラスの境界面で照明光を境界面に平行に近い角度で入射すると、全反射が起こる。全反射の際には、試料側にごく薄く表面から深さ50~200 nm(ナノメートル)程度の近傍のみに光(エバネッセント光)が沁み出る。このエバネッセント光を蛍光の照明として用いる手法。対物レンズの縁にレーザー光を入射して全反射を起こし照明に用いる方法が、対物レンズ型全反射照明法で、余分な装置が不要なため普及している。全反射照明法を用いると、余分なところを照らさない局所的な照明であることと、照明光強度が入射光の約4倍強くなるため、鮮明な画像が得られる。
[用語5] 薄層斜光照明(HILO照明)法 : 対物レンズに照明光を入射するのに、全反射照明よりも少しだけ対物レンズ中心軸寄りにレーザー光を入射すると、試料の内部を薄く照明することができる手法。細胞内を鮮明に分子イメージングすることができる。対物レンズ型全反射照明法と同じ顕微鏡で行うことができ、局所的な照明であることと、照明光強度が入射光の2~3倍余り強くなるために、鮮明な画像が得られる。
[用語6] マイクロクラスター : T細胞が活性化する際に、T細胞膜に形成されるT細胞受容体複合体(TCR/CD3)の数十~数百分子の集合体。シグナル伝達分子も結合する。T細胞受容体分子複合体が、抗原提示細胞により提示された抗原と結合すると、マイクロクラスターが形成される。これにより、T細胞受容体シグナルが伝達され、T細胞が活性化される。マイクロクラスターは、大きさを増しながら、細胞接着面の中心部分へと移動集積し免疫シナプスと呼ばれる構造を形成する。
[用語7] リン酸化、リン酸化酵素 : リン酸基を付加するのがリン酸化反応であり、この反応を生体中で触媒するのがリン酸化酵素でありキナーゼとも呼ばれる。シグナル伝達においては、タンパク質アミノ酸残基の水酸基がリン酸基で置換されリン酸化されることが、シグナルとして用いられている。
[用語8] 人工の細胞膜 : 人工的に作成した脂質二重膜をカバーガラス表面上に一層のみ敷き、脂質二重膜中に必要なタンパク質等の分子を埋め込んで、細胞膜の代替としたもの。脂質二重膜は、膜中や膜上の分子が自由に動くことができるので、膜分子の動きを細胞本来のまま観察することができる。一層の脂質二重膜を均質にガラス表面上に形成するためには、通常特殊な装置と熟練とが必要とされるが、本研究では、研究グループが以前に開発した簡便な方法を用いて、人工細胞膜法研究の難点を克服している。
[用語9] 拡散係数 : 分子が拡散により広がってゆく速さを数値化したもの。数値が大きいほど、速く拡散することを意味する。分子はランダムな熱運動(ブラウン運動)をしながら拡散してゆくが、分子の移動距離を二乗した平均値は、拡散係数と時間とに比例する。アインシュタインは、単純な拡散の場合には、拡散係数は分子の直径に反比例することを示した。なお、拡散係数はマクロな現象で定義され、物質が拡散する際の濃度の時間変化の大きさを表す係数(拡散方程式の係数)としての意味がある。
論文情報
掲載誌 : |
Scientific Reports |
論文タイトル : |
Multi-color single-molecule tracking and subtrajectory analysis for quantification of spatiotemporal dynamics and kinetics upon T cell activation |
著者 : |
Yuma Ito, Kumiko Sakata-Sogawa, Makio Tokunaga |
DOI : |
お問い合わせ先
東京工業大学 生命理工学院 教授
徳永 万喜洋(とくなが まきお)
E-mail : mtoku@bio.titech.ac.jp
Tel : 045-924-5711 / Fax : 045-924-5831
取材申し込み先