研究
研究

vol. 35
科学技術創成研究院 細胞制御工学研究センター 教授
木村宏(Hiroshi Kimura)
からだを作っている細胞はみな同じゲノムをもつが、遺伝子の働きが制御されることで細胞はさまざまな性質をもつようになる。このメカニズムの解明に取り組んでいるのが木村宏教授だ。

ヒトの身体は約30兆個もの細胞で構成されている。心臓、神経、皮膚などそれぞれの細胞は形や大きさ、働きなどが大きく異なるが、元をたどれば、受精卵というたった1個の細胞に行き着く。すべての細胞は実は同じゲノム(遺伝情報)をもっているのだ。
ではなぜ、同じゲノムであるにもかかわらず、異なる細胞に分化するのか。それはゲノムに含まれる全ての遺伝子のうち、細胞ごとに働いている遺伝子の種類や量が異なるからだ。細胞は遺伝子のオン・オフを制御し、必要な遺伝子を、必要なときに、必要なだけ働かせているのである。この遺伝子のオン・オフを制御するしくみのひとつを「エピゲノム」という。エピ(epi)は「後から・付加された」という意味で、ゲノムに加わる情報のことをエピゲノムと呼ぶ。そして、このエピゲノムを制御するメカニズムの解明に取り組んでいるのが、木村宏教授だ。
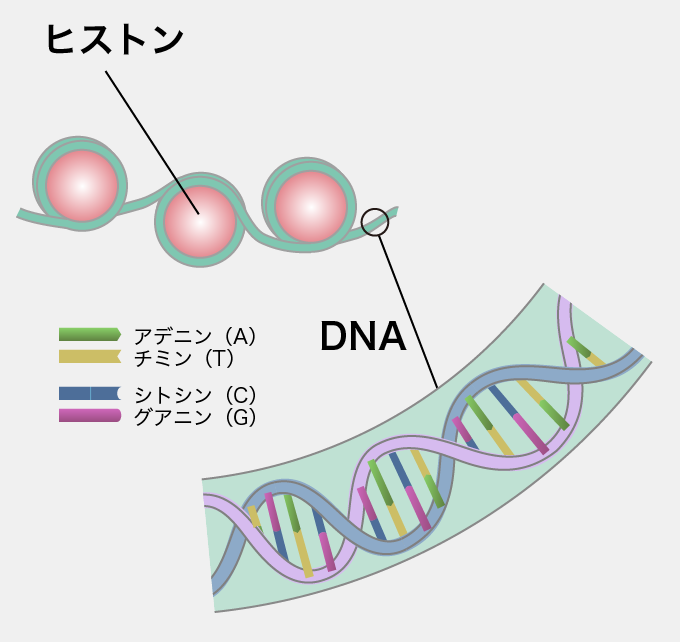
ゲノムを担うのは、「DNA(デオキシリボ核酸)」と呼ばれる物質で、細胞の核の中に収納されている。DNAは、アデニン(A)、チミン(T)、グアニン(G)、シトシン(C)という4種類の塩基が並んだ2本のひもが、二重螺旋構造をしている。AとT、GとCがそれぞれ対をなしており、この塩基対の並び方を「塩基配列」と呼ぶ。この塩基配列が遺伝情報として働くのだ。ヒトの細胞に含まれるDNAを引き伸ばすと約2メートルに及ぶが、細胞の中でDNAは、「ヒストン」と呼ばれるタンパク質に巻きついた状態になり、直径0.01ミリメートル程度の細胞核に巧妙に収納されている。
遺伝子が働く際には、まず、遺伝子の部分の塩基配列が読み取られ、mRNA(メッセンジャーRNA)という物質に転写される。そして、mRNAに転写された情報通りにアミノ酸がつながれていく。これを翻訳という。
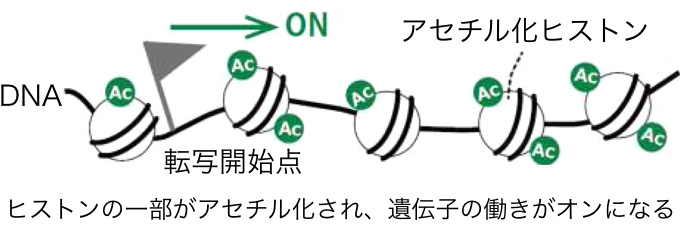
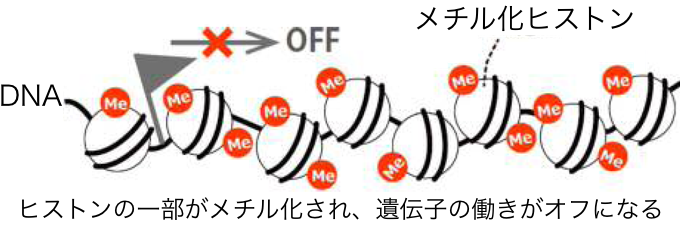
このmRNAの産生が遺伝子のオンであり、使われない(オフ状態の)遺伝子ではmRNAに情報が転写されない。遺伝子オフの調整には、基本的にDNAの塩基配列とその配列を読み取って結合するタンパク質が関わっているが、それ以外に、DNAやヒストンの一部に特殊な"印"を付ける(修飾する)ことでも、遺伝子のオン・オフが調整されることがわかっている。特殊な印とは、メチル基やアセチル基といった原子団※1を結合させるというものだ。メチル基を付けることをメチル化、アセチル基を付けることをアセチル化という。例えば、遺伝子制御領域のDNAがメチル化されると、遺伝子の働きがオフになり、逆に、付いていたメチル基が外れるとオンになる。また、ヒストンの一部がメチル化されると、遺伝子の働きがオフになり、逆に、ヒストンの一部がアセチル化されると、遺伝子の働きがオンになることが知られている。
このように、遺伝子の働きのオン・オフを制御するためにDNAやヒストンに特定の印がつけられた状態のゲノムをエピゲノムというわけだ。
ヒストンの修飾
「幹細胞※2から皮膚や心臓などの細胞への分化は、エピゲノムの変化も重要なので、DNAやヒストンの修飾をコントロールして狙った遺伝子の働きを自由にオン・オフできるようになれば、再生医療や病気の治療などに役立ちます。しかし、そのメカニズムは非常に複雑で、よくわかっていないのが現状です」と木村は語る。
DNAやヒストンの狙った場所にメチル基やアセチル基を付けたり外したりして、遺伝子の働きのオン・オフを制御することを「エピゲノム編集」という。ここで、「ゲノム編集」という言葉を思い浮かべる人も多いことだろう。ゲノム編集は遺伝子自体を改変しているため、元に戻すことができないのに対し、エピゲノム編集の場合、遺伝子自体は改変していないので、元に戻すことが可能な点が大きな違いだ。
エピゲノムのメカニズムの解明に向けては、まずは、観察することが第一歩だ。そのため、これまで、細胞を取り出して、顕微鏡で観察するという方法が採られてきた。これはこれで重要なことだが、これだけでは、DNAやヒストンのどこに化学基が修飾しているかはわかるものの、その動きを観察することはできない。
そこで、生きた細胞のタンパク質に蛍光タンパク質※3を付けて観察する方法が考えられた。しかし、そこにも課題があった。メチル基やアセチル基は小さいため、蛍光タンパク質を結合させることができないのだ。加えて、ヒストンのどの場所がメチル化されるかによっても、遺伝子のオン・オフの状況は変わってくる。場所を詳しく特定する必要があるが、その方法が見つかっていなかった。
そこで、生きた細胞で、ヒストンの特定の場所での化学修飾を検出するため、木村が考えた方法が、抗体を使うというものだった。抗体とは、病原体などが体内に入ってきたとき、それと特異的に反応する物質として体内に生ずるもののことで、抗原抗体反応で知られる。「まず、特定の場所がメチル化やアセチル化されたヒストンの抗体を作ることからはじめました。さらに、私が考えたことは、その抗体に蛍光を付け、それを細胞の核の中に入れたり発現させたりするということです。それにより、その抗体が細胞の核の中で、メチル基やアセチル基に反応するので、ヒストンのメチル化やアセチル化されている場所が、詳しくわかります。また、メチル基やアセチル基は結合したり離れたりするわけですが、その様子も蛍光タンパク質によって観察できるようになりました」と木村。
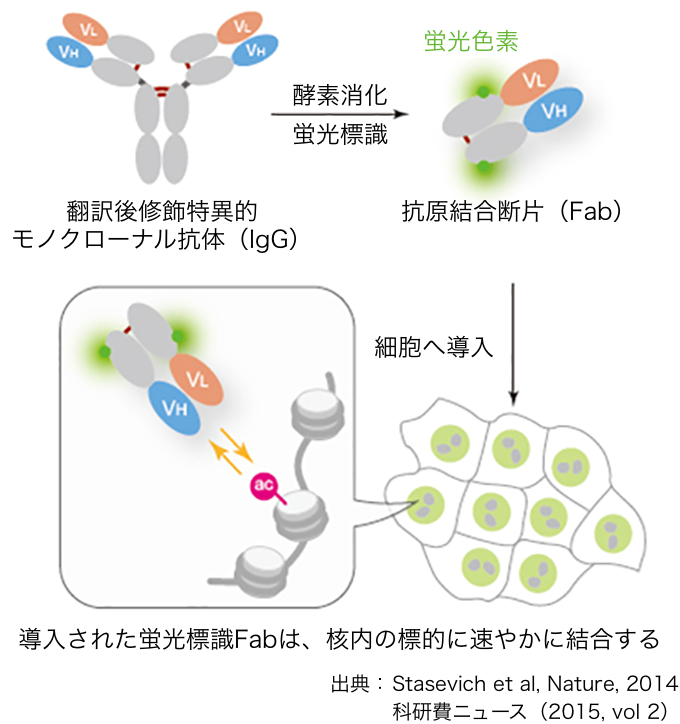
蛍光で標識した抗体を生きた細胞に導入することでメチル化やアセチル化された場所や挙動を調べることができる
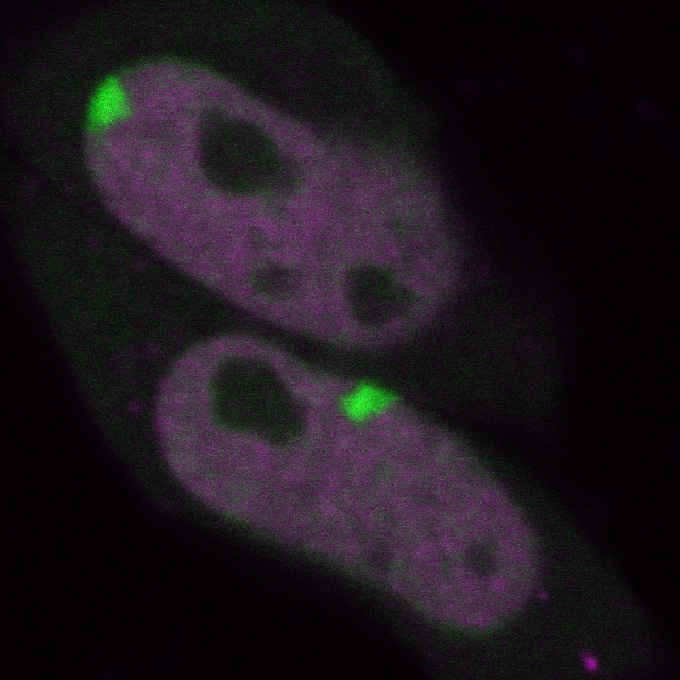
ヒストン修飾の様子を顕微鏡で観察
実は抗体は大き過ぎて、そのままでは、細胞の核の中に入っていかなかった。そのため、木村は、抗体の必要な部分だけを切り取り、小さくした上で、細胞や受精卵の中に注入するという方法を考案し、成功させたのである。
ところが、この方法では、実験のたびに抗体を細胞に注入しなければならず手間がかかる。そこで、さらに木村が考案したのが、抗体の遺伝子をクローニング技術により作成し、それを蛍光タンパク質として融合させたものを細胞で発現させることだった。それにより、核の中ではmRNAができ、抗体の断片と蛍光タンパク質の融合タンパク質が生成される。この方法であれば、1回1回、小さくした抗体を細胞の中に注入する必要がないというわけだ。
現在、木村は、これらの方法を動物培養細胞やゼブラフィッシュの卵に適用し、刺激や発生・分化におけるヒストンの修飾の変化の様子などを顕微鏡を使ってつぶさに観察することで、遺伝子発現の制御機構のメカニズムに迫ろうとしている。

「そもそも、私が細胞生物学の世界に入ったきっかけは、学生時代に、セントラルドグマ※4を知り、生命の根源であり、普遍性というものに魅了されたからです。現在、エピゲノムの分野には、たとえば、エピゲノム編集によって、iPS細胞などの幹細胞から、さまざまな臓器を作ることを目指す方など、色々な研究者がいらっしゃいます。一方、私の場合は、遺伝子発現の制御機構の根本的なメカニズムを知りたいので、それを知るための方法として、現在、観察に関する独自技術の開発を中心に進めています。新しい技術を開発することで、新たな発見があり、研究が広がっていきます。また、競争が激しい分野ですが、独自の技術を開発することで、激しい競争に巻き込まれることなく、自分のペースで研究を進めることができます」と木村は語る。
木村がこのような独自の路線をいくという研究スタイルを取るようになった背景には、大学院生時代の苦い経験があった。「あるプロジェクトがどうやってもうまくいかず、袋小路に入りました。その中で、ある目的に対して何をすればよいか、独自の発想を持たなければ、突破できないと思い知らされました。さまざまなアイデアを自分で考えて試す中、失敗のほうが多いのですが、まれにうまくいく場合があります。その経験が大きな自信になっています。今後も、開発した技術を組み合わせることで、近い将来にエピゲノムが変動する様子の全貌をとらえたいと思っています」と木村は語る。
最後に、研究者を目指す学生に向け、メッセージを送ってくれた。
「最近は、就職先が見つからないのではないか、研究の予算が厳しいのではないかなど、将来に対して悲観的な考えをもつ学生が多いように思います。しかし、私はもっと楽観的に考えてよいのではないかと思っています。しっかりとやるべきことをやっていれば、おのずと成果も出るでしょうし、希望する仕事もできるようになると思うからです。ですから、あまり先々のことを考えて保守的にならないでほしいですね。これだと思う研究を追求し続ければ、道は開けるのではないでしょうか。これは研究に限らず、すべてに言えることだと思いますよ」

すずかけ台キャンパスにある木村研究室
化学反応の時に、まとまった原子の集団として、1つの分子から他の分子に移ることができるような(化合物の分子中に存在する共有結合をなした原子の)集団のこと。官能基などの「基」に相当し、メチル基CH3-、エチル基C2H5-、アセチル基CH3CO-、水酸基HO-、リン酸基H2PO4-などがある。普通は分子の中で他の原子と結合して存在する。
我々の身体は健康を維持するため日々細胞を作っている。その細胞の供給源になるのが幹細胞である。幹細胞には色々な種類がある。たとえば、血液は造血幹細胞から作られるなど、我々の身体のそれぞれの臓器は異なる幹細胞を持っていると考えられている。一方で、胚性幹細胞は、血液や骨、皮膚、脳など体の中のすべての組織や臓器になることができる幹細胞だ。また、iPS細胞は人工的な多能性幹細胞で、胚性幹細胞とほとんど同じ性質を持っている。
蛍光を発するタンパク質。任意のタンパク質の遺伝子と蛍光タンパク質の遺伝子を融合させたものを細胞内に導入することで、タンパク質分子の場所や動きなどを生きた細胞で計測することができる。2008年にノーベル化学賞を受賞した下村脩博士が発見したオワンクラゲの緑色蛍光タンパク質などがある。
セントラルドグマ(Central dogma)とは、1958年に、DNAの二重螺旋構造を発見した科学者の1人であるフランシス・クリックが提唱した分子生物学の基本原則。これによれば、生物の遺伝情報はすべて、ゲノムDNA(複製)→mRNA(転写)→タンパク質(翻訳)の順に情報が伝達されていると考えられていた。しかし、1970年にRNAからDNAが合成されるという現象が発見されるなどにより、現在、セントラルドグマの概念はかなり修正が加えられている。とはいえ、セントラルドグマの概念を明らかにしようとしたことにより、mRNA(メッセンジャーRNA)やtRNA(転移RNA)が発見されるなど遺伝子発現に関する研究が進んだことの意義は大きい。

木村宏(Hiroshi Kimura)
科学技術創成研究院 細胞制御工学研究センター 教授
スペシャルトピックスでは本学の教育研究の取組や人物、ニュース、イベントなど旬な話題を定期的な読み物としてピックアップしています。SPECIAL TOPICS GALLERY から過去のすべての記事をご覧いただけます。
2019年2月掲載