- 転写因子NFκB・・・
- 炎症応答や免疫応答に重要な働きをする転写因子。細胞の核内でDNAに結合し、標的遺伝子(炎症応答や免疫応答に関与する遺伝子)の機能をオンにする働きを持つ。
東工大ニュース
東工大ニュース
公開日:2012.10.09
東京工業大学大学院生命理工学研究科の山口雄輝准教授とイスラエル・ワイツマン科学研究所(Weizmann Institute of Science)のリヴカ・ディクスタイン(Rivka Dikstein)博士らのグループは、正常な体の中で過剰な炎症反応がどのような仕組みで抑制されているのかを明らかにした。様々な炎症応答には「NFκB」と呼ばれる転写因子(用語1)が重要な役割を果たしている。同グループはメッセンジャーRNAの合成を制御する「DSIF」という因子(用語2)が、NFκBの働きを妨げる役割の因子(阻害因子)を活性化することを突き止めた。
NFκB阻害因子が正常に働かず、炎症反応が過剰になると、関節リウマチや全身性エリテマトーデス、クローン病といった自己免疫疾患を引き起こすことが知られている。今回の研究成果はこうした自己免疫疾患の発病のメカニズムを明らかにしたもので、適切な...
東京工業大学大学院生命理工学研究科の山口雄輝准教授とイスラエル・ワイツマン科学研究所(Weizmann Institute of Science)のリヴカ・ディクスタイン(Rivka Dikstein)博士らのグループは、正常な体の中で過剰な炎症反応がどのような仕組みで抑制されているのかを明らかにした。様々な炎症応答には「NFκB」と呼ばれる転写因子(用語1)が重要な役割を果たしている。同グループはメッセンジャーRNAの合成を制御する「DSIF」という因子(用語2)が、NFκBの働きを妨げる役割の因子(阻害因子)を活性化することを突き止めた。
NFκB阻害因子が正常に働かず、炎症反応が過剰になると、関節リウマチや全身性エリテマトーデス、クローン病といった自己免疫疾患を引き起こすことが知られている。今回の研究成果はこうした自己免疫疾患の発病のメカニズムを明らかにしたもので、適切な治療法の開発に貢献するものである。
この成果は10月5日に米科学誌「Cell Reports」(Cellの姉妹誌)に掲載される。
様々な炎症応答にはNFκBと呼ばれる転写因子が重要な役割を果たしている。腫瘍壊死因子「TNF」等のサイトカイン(用語3)によって細胞が刺激を受けると、不活性型のNFκBは活性化されて転写因子としての機能を獲得し、標的遺伝子(炎症応答や免疫応答に関与する遺伝子)の機能をオンにすることで炎症反応を誘導する。
しかしNFκBの活性化状態は通常1時間くらいしか持続しない。炎症がいつまでも続かない、というのは生物にとって好ましいことだが、そうなる理由はNFκBの活性化から少し遅れて「IκB」や「A20」といったNFκB阻害因子(用語4)が活性化され、NFκBの働きを抑えるからである。
IκBやA20の働きは遺伝子の転写レベルで制御されており、実はNFκB自身によって制御されている。つまり、NFκBが活性化されると、NFκBはIκBやA20を活性化し、そうすると今度はNFκBが不活性化される、といった負のフィードバック制御が存在している(図1)。しかしながら、NFκBの活性化機構に較べると、NFκBの不活性化機構はまだ十分に理解されていない。
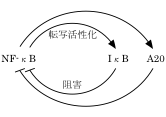
図1.炎症反応の負のフィードバック制御。NFκBは転写因子としてIκB遺伝子やA20遺伝子の転写を活性化する。一方、IκBやA20はNFκB阻害因子として働いて、NFκBの活性化を減衰させる。この仕組みにより、NFκBの活性化の期間は制限されている。
今回、山口准教授らのグループは、DSIFという因子が、これまでに知られていなかった作用機構でIκBやA20といったNFκB阻害因子を活性化し、NFκB活性化の期間を制限していることを明らかにした。
DSIFは山口准教授が東京工業大学の半田宏名誉教授や横浜市立大学の和田忠士准教授らとともに以前、発見したタンパク質である。DSIFはRNAポリメラーゼIIに結合してメッセンジャーRNAの合成を正負に制御することがこれまでに分かっており、「遺伝子DNA→メッセンジャーRNA→タンパク質」という遺伝子発現(用語5)の新たな律速段階をつかさどる因子として注目されている。
今回の研究から、NFκBによって引き起こされるIκB遺伝子やA20遺伝子の転写活性化にDSIFが重要な役割を果たしていることが明らかになった。とりわけ興味深いことに、DSIFは予期されたメッセンジャーRNAの合成段階ではなく、メッセンジャーRNAのキャッピングやスプライシング、核外輸送(用語6)の段階を促進していた。
一般に、合成直後のメッセンジャーRNAは「未成熟」であり、こうしたプロセシング反応を受けて成熟する。他の多くの遺伝子とは異なり、IκB遺伝子やA20遺伝子では、こうしたプロセシング反応が遺伝子発現の律速段階(ボトルネック)になっていることが、今回の研究結果から示された。
つまりNFκBの阻害因子であるIκBやA20は、NFκB自身によって活性化されるが、メッセンジャーRNAのプロセシング反応がIκBやA20遺伝子の発現を遅らせていたわけだ。DSIFはその律速段階に働き、IκBやA20の遺伝子発現を促進することで、NFκBの不活性化に寄与していることが分かった(図2)。
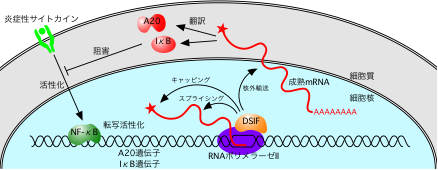
図2.炎症反応の調節に果たすDSIFの役割。
DSIFはA20やIκBといったNFκB阻害因子の遺伝子発現を促進することで、
NFκBの不活性化に寄与している。DSIFはこれらの遺伝子から作られる
メッセンジャーRNAのキャッピングやスプライシング、核外輸送を促進する。
NFκB阻害因子が正常に働かず、炎症反応が過剰になると、関節リウマチや全身性エリテマトーデス、クローン病といった自己免疫疾患を引き起こすことが知られている。今回の成果は、こういった自己免疫疾患の病態解明に貢献するものである。
今回の結果から、IκB遺伝子やA20遺伝子は他の多くの遺伝子とは異なる制御を受けていることが示されたが、どのような分子的基盤によってそのような違いが生じているのかは不明であり、今後、明らかにして行く必要がある。
本研究は、独立行政法人 科学技術振興機構(JST)の戦略的研究推進事業さきがけの研究領域「エピジェネティクスの制御と生命機能」(研究総括:向井常博 西九州大学学長)の研究課題(研究者:山口雄輝)の一環として行われた。
用語説明
発表先:Cell Reports
発表日:2012年10月5日
論文名:DSIF restricts NFκB signaling by coordinating elongation with mRNA processing of negative feedback genes
著 者:Gil Diamant, Liat Amir-Zilberstein, Yuki Yamaguchi, Hiroshi Handa, Rivka Dikstein
本件に関するお問い合せ先
山口 雄輝
大学院生命理工学研究科 生命情報専攻 准教授
電話: 045-924-5798 FAX: 045-924-5834
E-mail: yyamaguc@bio.titech.ac.jp