東工大ニュース
東工大ニュース
公開日:2014.11.11
東京工業大学資源化学研究所の西山伸宏教授と野本貴大助教らは東京大学大学院工学系研究科・医学系研究科の片岡一則教授らと共同で、光に応答して遺伝子を細胞に導入することができるナノマシン[用語1] を開発し、ナノマシンの全身投与後にがんに光を照射することで、がんへの光選択的な遺伝子導入に世界で初めて成功した。この研究成果は、日本学術振興会、科学技術振興機構、武田科学振興財団の支援によるもので、英国オンライン科学雑誌「Nature Communications」に4月2日付けで掲載された。
遺伝子に異常を持つ細胞に、タンパク質の設計図であるDNAを送り届けて異常を治す遺伝子治療は、既存の医薬品では治療が困難な、がん、動脈硬化症、パーキンソン病などの難治性疾患を克服する技術として大きな期待を集めている。しかし、DNAは生体内に投与されると即座に分解されてしまうため、遺伝子治療を実現するためには、目的のDNAを疾患部位の標的の細胞まで確実に届けることができる、DNAの運び屋(ベクター)が必要である。
現在、ベクターとしてはウイルスや、脂質をベースとした非ウイルス性の試薬が一般的に使用されている。だが、これらを生体に投与した場合、正常な細胞にも遺伝子が導入されてしまい、予期せぬ副作用を惹起してしまうことが懸念されていた。そのため、標的となる疾患部位だけに遺伝子を導入することができるベクターの開発が望まれていた。
研究グループはこれらの課題を解決するための機能を高分子ミセル[用語2] に統合することで、光照射部位で選択的に遺伝子を導入することができるナノマシンを開発した。ナノマシンは、図1のように、ABC型トリブロック共重合体という異なる3つの機能セグメントを持つ高分子とDNA、そして光で活性化すると活性酸素を産生する薬剤(光増感剤)の水中における自己会合により作製される。ナノマシンは、DNAを内包した内核層、光増感剤を内包した中間層、生体適合性材料の外殻層という三層構造を持っており、それぞれの層が効率的な遺伝子導入を行うための機能を持っている。
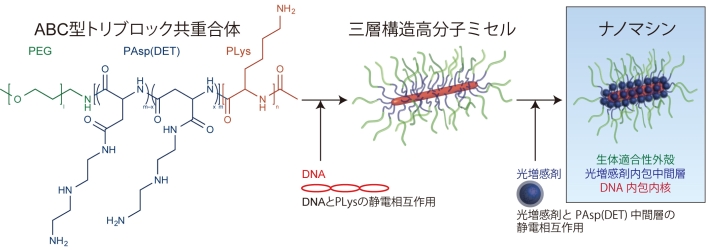
図1. ナノマシンの構築方法と構造。ABC型トリブロック共重合体、DNA、光増感剤を水中で順次に自己会合させることによりナノマシンが構築される。
ナノマシンは血中に投与されると、生体適合性外殻により生体物質の吸着を抑制し、さらにDNAを内核に閉じ込めておくことにより、DNAの分解を回避しながら血流中を循環する。がん組織の血管は未熟な構造をしており、血管壁にナノスケールの穴が開いているため、ナノマシンはこの穴を通してがん組織に移行することが可能である。そして、ナノマシンはがん細胞にエンドサイトーシス[用語3] と呼ばれる経路で細胞に取り込まれ、エンドソーム・リソソーム[用語4] と呼ばれる細胞の胃袋のようなものに運ばれる。
一般的にDNAそのものはそこから細胞質に移行することができないため、核まで到達することができない。そこで、ナノマシンは、エンドソーム・リソソーム内の酸性環境を検知して光増感剤を放出し、エンドソーム・リソソームの膜と相互作用させる。そこに光を当てて光増感剤を活性化すると、活性酸素が産生されてエンドソーム・リソソーム膜を壊し、DNAを細胞質に移行させることができる (図2)。このナノマシンの機能により、培養がん細胞に対する遺伝子導入の実験では、光照射を行うと遺伝子導入効率が100倍以上上昇することが確認された。さらに、皮下にがんを持つマウスにナノマシンを静脈注射した後、がんに光照射することにより、全身投与後の光選択的遺伝子導入に世界で初めて成功した。
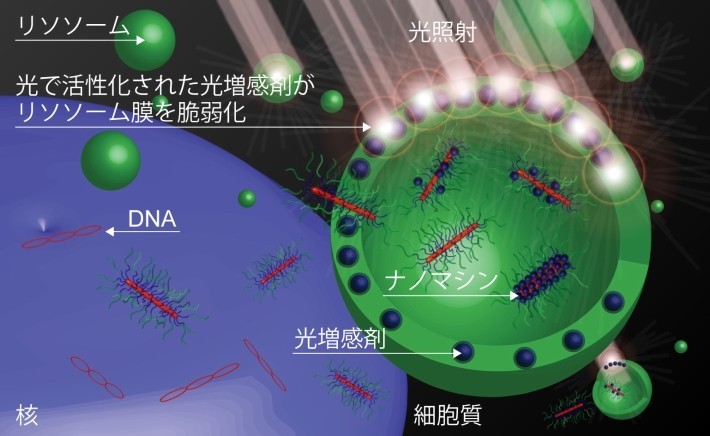
図2. 細胞内の環境と光に応答してDNAの細胞質への移行を促進するナノマシン。エンドソーム・リソソーム内の環境に応答してナノマシンは光増感剤を放出し、エンドソーム・リソソーム膜に相互作用させる。光照射により活性化された光増感剤は活性酸素を産生しエンドソーム・リソソーム膜を不安定化させ、DNAの細胞質への移行を促進する。
薬剤を内包した高分子ミセルは、制がん剤をがん組織に選択的に運搬する運び屋として、西山教授、片岡教授らにより世界に先駆けて開発された技術であり、現在、パクリタキセル内包高分子ミセル、シスプラチン内包高分子ミセルの臨床試験が第三相まで進められており、日本発世界初の高分子ミセル型ナノメディシンとして市場に出ることが期待されている。本研究で開発されたナノマシンは、この高分子ミセルをさらに発展させたものであり、外部刺激となる光でピンポイントに積極的にタンパク質の設計図となるDNAを標的細胞に送り込むことができる技術である。
今回の研究ではレポーター遺伝子を用いて光選択的遺伝子導入を実証したが、将来的には治療用タンパク質をコードしたDNAをがん組織中の細胞に選択的に送り込み、その場で治療薬を生産することにより副作用を最小限にとどめた、低侵襲治療を実現するためのシーズとして期待される。
用語説明
[用語1] ナノマシン : 環境や外部刺激に応答して自律的に様々な機能を実行するナノサイズの機械。
[用語2] 高分子ミセル : 親水性のポリマーと疎水性ポリマーまたは荷電性ポリマーをつなげた高分子が、疎水性相互作用や静電相互作用を駆動力として自己会合することにより形成されるナノサイズの粒子。親水性ポリマーが外殻相を形成し、疎水性ポリマーまたは荷電性ポリマーが内核を形成する。
[用語3] エンドサイトーシス : 細胞外の物質を細胞が内部に取り込む際の経路の一つ。物質を細胞膜で覆うようにして小胞をつくり内部に取り込む。
[用語4] エンドソーム・リソソーム : エンドソームはエンドサイトーシスによって形成される小胞を指す。エンドソームは最終的に分解酵素を含むリソソームと融合し、エンドソーム内の物質を分解する。
論文情報
掲載誌 : |
Nature Communications |
論文名 : |
Three-layered polyplex micelle as a multifunctional nanocarrier platform for light-induced systemic gene transfer |
執筆者 : |
Takahiro Nomoto, Shigeto Fukushima, Michiaki Kumagai, Kaori Machitani, Arnida, Yu Matsumoto, Makoto Oba, Kanjiro Miyata, Kensuke Osada, Nobuhiro Nishiyama*, Kazunori Kataoka*
|
DOI : |
お問い合わせ先
資源化学研究所 高分子材料部門
教授 西山伸宏
Email: nishiyama@res.titech.ac.jp
TEL: 045-924-5240 / FAX: 045-924-5275