東工大ニュース
東工大ニュース
公開日:2014.11.20
東京工業大学の大学院生命理工学研究科 上野隆史教授と藤田健太大学院生らは、細胞内に送り込んだ一酸化炭素(CO)をゆっくりと放出させ、癌(がん)の原因となる転写因子たんぱく質の活性を制御することに成功した。直径12ナノメートル(nm)のフェリチン[用語1] と呼ばれるカゴ状たんぱく質に、毒性の強いCO分子を閉じ込めるシステムの開発によって実現した。不明な点が多いCO分子の生体内での機能解明ばかりでなく、複雑で難しい医薬品製造を必要としない簡便な治療薬の開発につながると期待される。
上野教授らは、生体中で鉄を貯蔵するカゴ状たんぱく質であるフェリチンに着目し、12nmのカゴの内部に、金属と結合したCOを閉じ込め、細胞内に送り込んだ後に、ゆっくりとCOを放出するシステムを開発した。その結果、従来の化合物に比べ、効率よくCOを細胞内で作用させることができ、癌の原因となる転写因子たんぱく質の制御に成功した。
今回の成果は、内閣府の最先端・次世代研究開発支援プログラムの支援によるもので、化学分野において最も権威のある学術誌の一つである「Journal of the American Chemical Society(米国化学会誌)」のオンライン版で11月19日に公開される予定。
ガス分子である一酸化炭素(CO)は体内の多くのたんぱく質と強く結合し、身体に悪い影響を及ぼすことが古くから知られている。同時に、近年ではCOとたんぱく質の結合は炎症や癌化を抑制する働きを持つことが明らかになり、次世代の医薬品として注目されている。そのため、生体内のCO分子濃度や、その分布を制御する研究が盛んにおこなわれているが、微量のCO分子を生体環境へ安定に供給するシステムはいまだに確立されていなかった。その理由は、COを輸送するには金属にCOを結合させた化合物が必要であり、その毒性と不安定性の克服法がなかったことに原因があった。
上野教授らは、CO輸送化合物として使われている、ルテニウムカルボニル錯体[用語2] に着目し(図1a)、カゴ状たんぱく質フェリチンの内部へ集積することを試みた(図1b)。
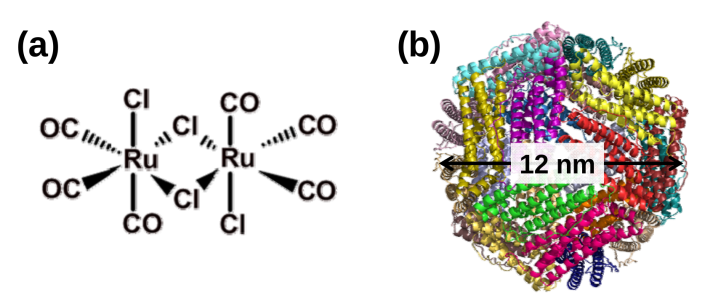
図1. ルテニウムカルボニル錯体の化学構造(a)及びフェリチンのX線結晶構造(b)。
フェリチンの内部に結合しているルテニウムカルボニルの様子はX線結晶構造解析によって明らかにした。さらに、生きたヒト胎児腎臓細胞(HEK293細胞)へ複合体を導入し、COを放出させることによって、従来のルテニウムカルボニル錯体と比較して、癌の増殖に関与する核転写因子NF-κB[用語3] をより効率的に活性化させることに成功した。
水溶液中でルテニウムカルボニル錯体分子とフェリチンを混和させることでCO放出フェリチン複合体1を合成した。X線結晶構造解析により、ルテニウムカルボニル錯体は、フェリチン内のGlu45とCys48[用語4] へ結合していることが分かった(図2)。このルテニウムが結合しているフェリチン内のアミノ酸残基を遺伝子工学的に改変することによって、さらにルテニウムカルボニル錯体の結合数を増加させた、複合体2を合成することにも成功した。
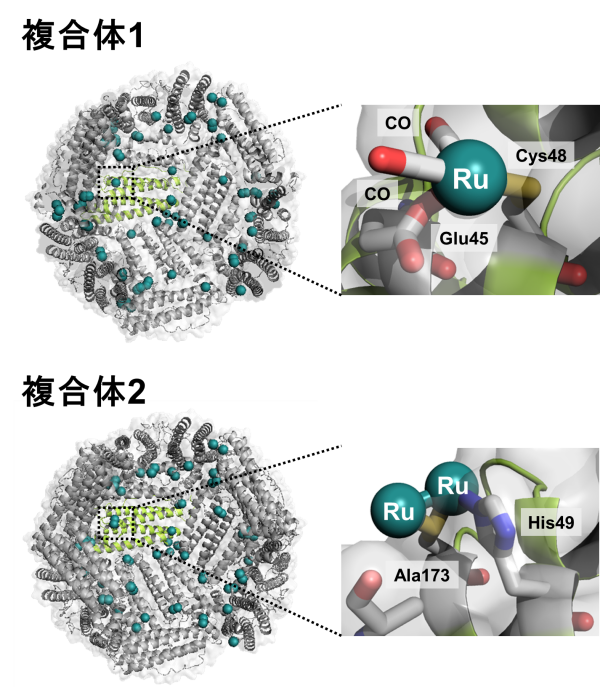
図2. CO放出フェリチン複合体1及び2のX線結晶構造及びそのルテニウムカルボニル結合部位の拡大図。
(青:窒素元素、黄色:硫黄元素、赤:酸素元素、深緑色:ルテニウム元素)
試験管内のCO放出実験からは、合成した複合体はルテニウムカルボニル錯体のみに比べ、18倍ゆっくりとCOを放出することが分かった。これは、CO放出の反応点がフェリチンの分子カゴに保護されているためだと考えられる。また、より多くのルテニウムカルボニル錯体を結合できる複合体2では、もとの複合体に比べて、COの放出量が2倍になっていることも分かった。
複合体をHEK293細胞へ導入し、NF-κBの活性化を評価した。従来のCO放出ルテニウムカルボニル錯体よりもCO放出フェリチン複合体は2.5倍、CO放出量の多い複合体ではさらにNF-κBの活性を4倍活性化する効果があることが分かった。
これらの成果から、(1)CO放出速度を遅くすること、(2)より多くのCOを送り込むことが、NF-κBの効率的な活性化に重要な点であるということを新たに見出した。
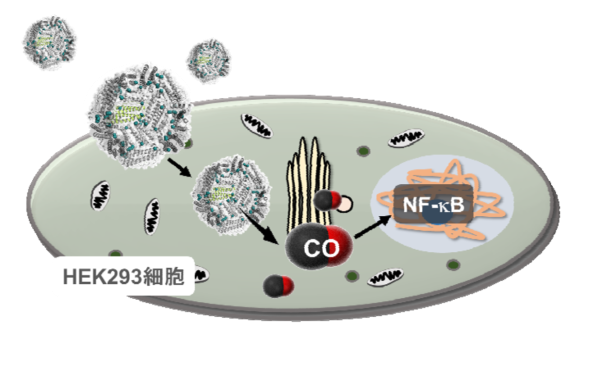
図3. CO放出フェリチン複合体のHEK細胞への導入及びCO放出、NF-κBへの作用のイメージ図。
本研究で開発したカゴ状たんぱく質を用いた一酸化炭素の細胞内輸送法は、化学、生物学、医学など多方面において注目されているガス状分子による生理活性機能の調節に対して新たな潮流を生み出すばかりではなく、医薬品開発に従来と全く異なる概念を提供する可能性を有している。具体的には(1)いまだに不明な点が多い、COの細胞内の機能解明、(2)たんぱく質工学を利用した新しい薬物輸送法の確立、(3)癌などの重篤疾患を標的とした医薬品開発への貢献―により、ガス分子によるテーラーメイド型医療の実現につながると期待される。
用語説明
[用語1] フェリチン : フェリチンは24個の単量体から構成される外径12nmのカゴ状のたんぱく質であり、分子量は約480万である。生理学的な機能としては細胞内の鉄の貯蔵の機能が知られており、直径8nmの内部空間で数千もの鉄イオンをFeIIからFeIIIへ酸化し、酸化鉄ミネラルの状態で集めることができる。また、鉄以外の金属イオンや有機小分子もその内部空間に集積できることがわかっている。
[用語2] ルテニウムカルボニル錯体 : 一酸化炭素を配位子にもつ遷移金属錯体の一種。CO放出分子としての利用のほかに、化学工業的に触媒としても利用されている。
[用語3] 核転写因子NF-κB(エヌエフカッパービー) : 転写因子の一種。アメリカのボルティモア教授(1975年ノーベル生理学医学賞受賞)らのグループによって発見された。細胞外からの刺激に応じて癌細胞内のNF-κBが活性化され、細胞機能維持のための種々のたんぱく質がつくられることにより癌細胞の増殖や転移が制御される。つまりNF-κBの活性制御機構の解明が、癌治療への有用な知見を与える。さらに近年ではNF-κBが活性化されることでのみつくられるたんぱく質の機能の重要性も注目されている。
論文情報
掲載誌 : |
Journal of the American Chemical Society |
論文タイトル : |
Intracellular CO Release from Composite of Ferritin and Ruthenium Carbonyl Complexes |
著者 : |
Kenta Fujita, Yuya Tanaka, Takeya Sho, Shuichi Ozeki, Satoshi Abe, Tatsuo Hikage, Takahiro Kuchimaru, Shinae Kizaka-Kondoh and Takafumi Ueno
|
DOI : |
問い合わせ先
大学院生命理工学研究科 生体分子機能工学専攻
教授 上野隆史
Email: tueno@bio.titech.ac.jp
TEL: 045-924-5844 / FAX: 045-924-5806