東工大ニュース
東工大ニュース
公開日:2017.11.14
東京工業大学の茶谷悠平研究員、丹羽達也助教、和泉貴士大学院生(研究当時修士課程2年)、菅田信幸大学院生(修士課程1年)、田口英樹教授、東京大学の長尾翌手可助教、鈴木勉教授、京都産業大学の千葉志信准教授、伊藤維昭シニアリサーチフェローの研究グループは、タンパク質が合成される途中で、リボソーム[用語1]の構造を不安定化することで、合成を終らせてしまうことがあることを発見、これが細胞の環境適応のために利用されていることを見出しました。
生命現象を担うタンパク質は、すべてリボソームというタンパク質合成装置で作られます。リボソームはDNAに書き込まれた遺伝暗号に従って、始点から終点までアミノ酸を一つずつ鎖状に繋げてタンパク質を合成します。最近、このアミノ酸を繋げていくスピードはいつも同じではなく、多くは途中で減速や一時停止することがわかってきました。
研究グループは、タンパク質合成過程で、アミノ酸の並び方によっては終点に至らなくてもリボソームを不安定化して合成を終了することを発見しました。さらに、この途中終了のしくみを細胞内のマグネシウムイオン濃度をモニターするのに使っていることも発見しました。これまでの分子生物学の常識では、タンパク質が合成される際の始点と終点は遺伝暗号により厳密に指定されていると考えられてきましたが、今回の発見で、DNAに刻み込まれた遺伝情報はタンパク質合成の途中終了も指令できることが判明しました。リボソームはタンパク質を合成する際大きな構造変化を余儀なくされるため、産みの苦しみとでも喩えられるような不安定化が起こることも示されました。この成果は、生命現象の理解を深めると同時に、有用タンパク質の生産などの応用へも波及効果が期待できます。
本研究成果は11月2日付けの米国の学術誌「Molecular Cell」電子版に掲載されました。
生命を支える機能分子であるタンパク質は、アミノ酸が連結した鎖(ポリペプチド鎖)が立体構造をつくったものです。この鎖のアミノ酸の並び方(配列)はDNA配列に書き込まれています。ポリペプチド鎖は、リボソームというタンパク質合成装置がDNA配列の写し(メッセンジャーRNA)に存在する始点(開始コドン)から20種類のアミノ酸を遺伝暗号に従って一つ一つ選んで連結し、終点(終止コドン)で鎖がリボソームから離れることによってできてきます。
リボソームでタンパク質が作られる過程は「翻訳」と呼ばれ、私たちヒトを含む全生物のタンパク質は全て例外なく翻訳を経て生まれてきます。従来は、リボソームでアミノ酸を連結していく過程で新たに生まれてくるポリペプチド鎖(新生鎖)は停滞することなく合成されると考えられていました。
最近の本研究グループの研究などから、新生鎖はアミノ酸配列によっては作り手であるリボソームに直接働きかけて翻訳のスピードにブレーキをかけるなど、翻訳には「緩急のリズム」が広範に存在することがわかってきました。
つまり、翻訳の産物である新生鎖が翻訳の進行自体に積極的に関わることが明らかにされたのです。研究グループは、翻訳速度を制御するアミノ酸配列を詳細に調べる過程で、合成途上のタンパク質が、リボソームに対して新たな作用を及ぼすことを見つけました。それは、リボソームの不安定化による翻訳中途終了です。
研究グループは、酸性アミノ酸(アスパラギン酸、グルタミン酸)が10回程度連続した配列、もしくは酸性アミノ酸とプロリンというアミノ酸が交互に連なった配列を含むタンパク質を大腸菌の再構成型無細胞翻訳系[用語2]で翻訳させた際に、翻訳が中途で終わることを見つけました。この中途終了が起こるとき、これらのアミノ酸配列を合成するリボソームが新生鎖の作用によって不安定化(IRD = intrinsic ribosome destabilizationと命名)し、最終的にリボソームが大小サブユニットに解離してしまいます(図1)。細胞内で数千から数万種類のタンパク質の合成を担うリボソームには、多様なアミノ酸配列の組み合わせを自在に連結する能力があると考えられてきましたが、自らが合成しつつある新生鎖によってリボソームが翻訳中に不安定化する現象(IRD)の発見は、翻訳が潜在的に中断のリスクを伴いながら進行するものであることを示しています。IRDを引き起こすアミノ酸配列を含むタンパク質は、合成が「最後」まで完了できない事態に陥ります。
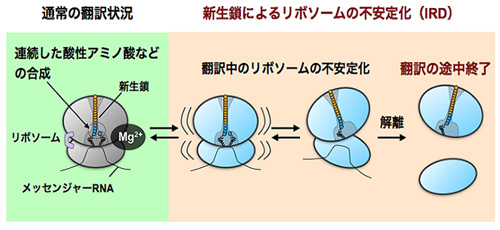
図1. 新たに合成されてきたタンパク質によるリボソームの不安定化と合成の途中終了
リボソームは多様なアミノ酸配列の組み合わせを自在に連結する能力があると考えられていたが、酸性アミノ酸の連続配列などの合成時には、合成されてきたタンパク質(新生鎖)によってリボソーム自身が不安定化(IRD)し、リボソームが大小のサブユニットに解離する。結果的にタンパク質合成は終点まで到達しないまま途中で終了する。
この一見リボソームの欠陥にも見えるIRD現象は生物にとって、どのような意味があるのでしょうか?
研究グループは、生物がIRDに対抗する機構も持っていることを発見しています。そこで、この機構が損なわれてリボソームが若干不安定になりIRDが起こりやすい大腸菌の変異株を用いて細胞内のタンパク質全体(プロテオーム)を解析しました。その結果、変異株では野生株に比べ、多くのタンパク質の発現量が変動すること、特にマグネシウムを細胞内に運ぶ膜輸送タンパク質の一つMgtAが10倍以上多く発現していることを見出しました。興味深いことにMgtAの発現を制御する遺伝子(mgtL)はIRD配列を持っていました。解析の結果、大腸菌は野生株においても細胞内のマグネシウム濃度に応じてmgtLのIRD配列を使った特殊な機構でMgtAの発現量を調節していることがわかりました。
マグネシウムイオンは細胞内の多くの生命現象に必須の金属イオンで、中でもリボソームを安定化することで翻訳に必須です。そこで、大腸菌はマグネシウムイオンが生育環境中で少なくなった際、mgtLのIRD配列を介してMgtAを大量に発現させてマグネシウムイオン濃度を高めるしくみを準備したと考えられます。つまり、生物はIRD現象を逆手にとって細胞内の環境変化をモニターするしくみを持っていることがわかりました(図2)。
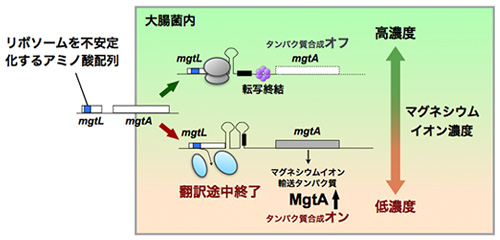
図2. 新生鎖に依存したリボソーム不安定化による細胞内マグネシウムイオン感知機構
マグネシウムを細胞内に運ぶ膜輸送タンパク質MgtAの発現を制御する遺伝子(mgtL)にはリボソーム不安定化配列があり、細胞内マグネシウムイオン濃度が低いときに翻訳が中断する。mgtLが翻訳中断するとMgtAの合成がオンになるメカニズムがあり、結果としてMgtAの大量発現によって細胞内のマグネシウムイオン濃度が高くなると考えられる。
生命現象を説明するセントラルドグマ[用語3]では、タンパク質はメッセンジャーRNAに存在する開始コドンから終止コドンまでリボソームがアミノ酸を途切れなく合成するものだと考えられていました。本研究では、アミノ酸配列にはタンパク質の立体構造の情報が書き込まれているだけでなく、自らを合成する装置の安定性を左右して翻訳を中途で終了させる働きまで潜んでいることを明らかにしました。これは、遺伝情報の発現を基礎とする生命現象の理解を深めるものです。
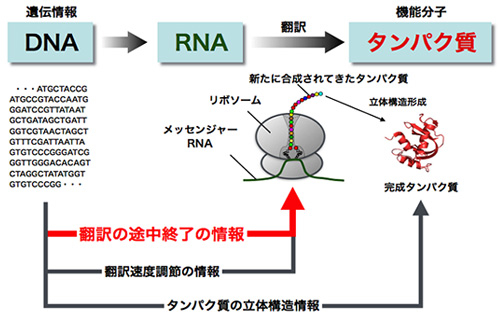
図3. 生命のセントラルドグマにおけるリボソーム不安定化現象の位置付け
DNA→RNA→タンパク質という遺伝情報の流れ(セントラルドグマ)において、遺伝子はタンパク質のアミノ酸配列の情報をDNA配列に書き込んでいる。このアミノ酸配列情報にはタンパク質の立体構造の情報に加えて、翻訳速度の調節や翻訳を途中終了させる情報も書き込まれていることがわかってきた。
さらに、本研究で発見されたアミノ酸配列をきっかけとして、今後さらに翻訳を途中終了させるアミノ酸配列が広く見つかる可能性があります。つまり、これまでの生命科学では翻訳の途中終了は考慮されていなかったため、今回の発見は、生命科学が関与する様々な応用研究に展開できると考えられます。
例えば、有用タンパク質を異種の生物で発現させる際にうまくいかない理由の一つに今回見つけたような翻訳の途上終結配列があることが予想できます。これまで作ることができなかったバイオ医薬など有用タンパク質の生産が本研究を契機に可能になることが期待できます。また、今回見つけたような環境応答機構がマグネシウム輸送系以外にも働いていることが予測され、遺伝子発現調節研究に新たな視点を導入する結果となりました。
用語説明
[用語1] リボソーム : RNAとタンパク質からなる巨大な複合体で、メッセンジャーRNAの塩基配列を読み取って、そこに書き込まれている遺伝暗号に従い20種類あるアミノ酸を選んで特定の順番に繋げていくことにより、タンパク質の鎖(ポリペプチド鎖)を合成する。
[用語2] 再構成型無細胞翻訳系 : タンパク質を合成するに必須の因子だけから 構成された試験管内でのタンパク質合成(翻訳)系。
[用語3] セントラルドグマ : DNA→RNA→タンパク質という情報の流れと変換を記述した分子生物学の根幹をなす概念のこと。大きくは、DNAの塩基配列の情報がメッセンジャーRNAに写される「転写」と、メッセンジャーRNA、トランスファーRNA、およびリボソームの共同作用でタンパク質を合成する「翻訳」に分かれる。
論文情報
掲載誌 : |
Molecular Cell 68, 528–539 (2017) |
論文タイトル : |
Intrinsic ribosome destabilization underlies translation and provides an organism with a strategy of environmental sensing(和訳:内発的なリボソームの不安定化が遺伝情報の翻訳過程に付随し、環境応答戦略に利用される) |
著者 : |
Y. Chadani, T. Niwa, T. Izumi, N. Sugata, A. Nagao, T. Suzuki, S. Chiba, K. Ito* and H. Taguchi*: |
DOI : |
お問い合わせ先
東京工業大学 科学技術創成研究院
細胞制御工学研究センター
田口英樹 教授
E-mail : taguchi@bio.titech.ac.jp
Tel : 045-924-5785 / Fax : 045-924-5785
京都産業大学 総合生命科学部 シニアリサーチフェロー
伊藤維昭
E-mail : kito@cc.kyoto-su.ac.jp
Tel : 075-705-2972 / Fax : 075-705-2972
取材申し込み先
東京工業大学 広報・社会連携本部
広報・地域連携部門
E-mail : media@jim.titech.ac.jp
Tel : 03-5734-2975 / Fax : 03-5734-3661
京都産業大学 広報部
E-mail : kouhou-bu@star.kyoto-su.ac.jp
Tel : 075-705-1411 / Fax : 075-705-1987