東工大ニュース
東工大ニュース
公開日:2017.11.22
東京工業大学 生命理工学院 生命理工学系の羽毛田聡子研究員と鈴木崇之准教授の研究グループは、神経軸索[用語1]が脳内のどの深さの層に接続するのかを決定する仕組み(遺伝子プログラム)を解明しました。
感覚神経などの神経の軸索は、層状に区画分けされた脳内に侵入、標的となる神経細胞を見つけ出し、接続して機能的な神経回路を形成します。これまで、この層特異的な神経細胞の接続をどのように行っているのかは、よくわかっていませんでした。
今回本研究グループは、ショウジョウバエの視神経系を用いて(図1)、最新の分子遺伝学的手法と共焦点レーザー顕微鏡を駆使し、神経接続の新たな仕組みを解明しました。この遺伝子プログラムは、2つの遺伝子が関係しており、どちらも受容体型チロシン脱リン酸化酵素[用語2]を産生しています。このチロシン脱リン酸化酵素の細胞内ドメイン[用語3]の活性の強さが強ければ強いほど、視神経の軸索がより脳の深層に到達することがわかりました。また、この遺伝子の活性は、軸索が脳に侵入する時には必要ではなく、標的となる神経細胞との接続を安定に維持するのに必要ということがわかりました。
この仕組みは、神経軸索回路形成における普遍的な原理原則として高等動物でも使われている可能性があります。この受容体型脱リン酸化酵素の重要な機能の発見は、神経回路形成の謎を解く重要な成果と言えます。
この成果は、2017年11月8日に国際科学誌「eLife」に公開されました。
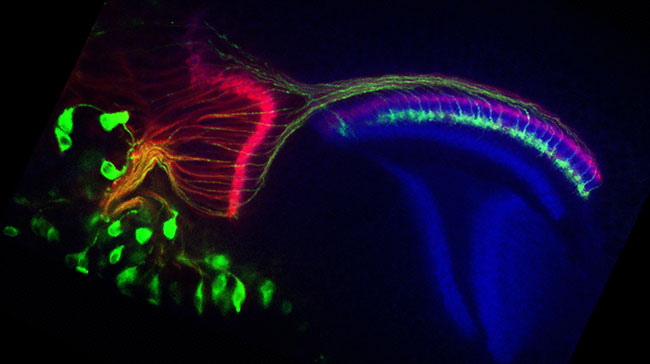
神経細胞は生まれてから、軸索を伸ばして次につながる神経細胞を探し当てます。この所謂「神経軸索の投射」という現象を通して、膨大な数の神経細胞がお互いにつながり、複雑な神経回路を形成します。道標となるタンパク質が軸索を決まった道に沿って誘導し、標的となる神経細胞へと導くことが知られています。
しかしながら、軸索を誘導されることだけではなく、接続した神経の軸索を安定化させ、維持していくことも神経回路にとって非常に大事なことです。安定化し損なった軸索は縮退を起こし、神経回路は形成されません。このような軸索接続の安定化と維持にかかわる遺伝子プログラムはほとんど分かっていませんでした。また、安定化する層がどのように決まっているのかも分かっていませんでした。
羽毛田聡子研究員と鈴木崇之准教授らは、別々に研究されていた2つの脱リン酸化酵素の変異体を同一個体に組み込んで二重変異体を作成することに成功しました。その変異体を解析したところ、いまだかつてないほどの距離を視神経の軸索が縮退して、最終安定化層が脳の非常に浅いところにあることを発見しました。この2つの遺伝子の機能が重複していたことが判明し、いままで隠されていた機能が解明されることになりました。その後の詳細な遺伝子操作による遺伝学的実験の結果、2つの遺伝子の強さと軸索投射層の深さが比例していることなどが明らかになっていきました。
ショウジョウバエの視神経軸索の投射で異常を起こす遺伝子として、LARとPtp69Dという2つの受容体型脱リン酸化酵素が知られていました。それぞれの変異体は似た表現型を示し、視神経軸索が脳内層に入った後、最後の1番深い層(図2の青い層)ではなく2番目に深い層(図2の赤い層)に留まるという比較的穏やかなものでした。しかし、この2つの遺伝子が異常を起こしている二重変異体を作成したところ、脳内の1番浅い層まで視神経の軸索が縮退し、ほとんど脳内に定着しないことが分かりました。つまり、この2つの脱リン酸化酵素は重複した重要な機能を有しており、これは神経の軸索を脳内の標的層に定着させ、安定化させることが分かりました(図2右)。
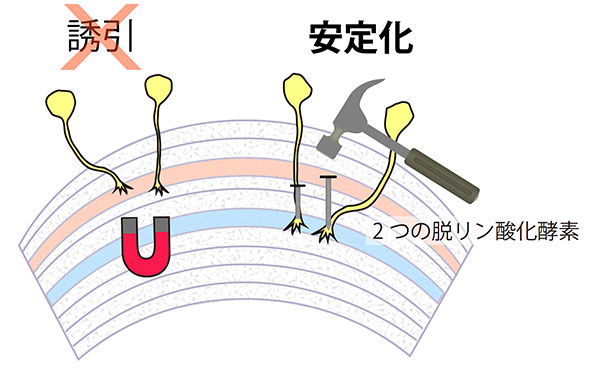
図2. 2つの脱リン酸化酵素の機能は「軸索の安定化」
神経軸索が正常な神経回路を形成するために、神経軸索は「誘引」され、後に「安定化」し、標的神経との接続を確立する。2つの脱リン酸化酵素は、後者の「安定化」のみに寄与し、「誘引」には関わっていないことが分かった。
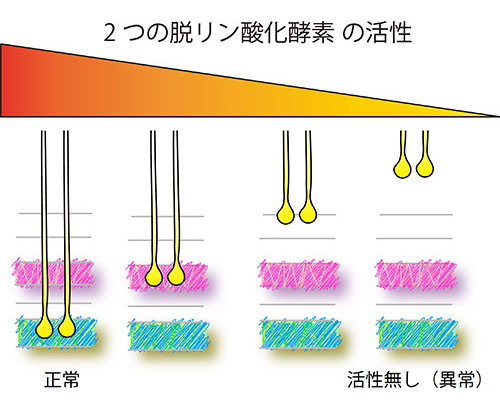
図3. 2つの脱リン酸化酵素の「活性」と軸索安定化層の「深さ」との関係
LARとPtp69Dの2つの脱リン酸化酵素の「活性」を徐々に弱めていくと、軸索の最終安定化層の「深さ」が徐々に浅くなっていく、という関係性が明らかになった。
次に、この2つの脱リン酸化酵素の「活性」が軸索を安定化させる層の「深さ」と関係があるのかを突き止めるために、遺伝子発現量を様々なレベルに調節し、様々な強さの変異が入った遺伝子断片を用いて実験しました。
その結果、視神経細胞の軸索が潜り、脳内で定着する層の「深さ」は、この2つの脱リン酸化酵素の「活性の強さ」に比例することが分かりました(図3)。また、これら脱リン酸化酵素は、互いに異なった外部シグナルを認識している一方で、内部の細胞内情報伝達は共通の因子を使っていることが示唆されました。これらのことから、2つの相同遺伝子を使って、脳内の神経回路を安定的に形作る普遍的な遺伝子プログラムが明らかになりました。
なぜ脱リン酸化酵素の細胞内ドメインの強度が強いほど、軸索は深い層で安定化することができるのか?という問題に対する解答は得られていません。また、これら脱リン酸化酵素のリガンド[用語4]は発見されておらず、細胞外からのシグナルがどのように安定化層を決定させているのかは、よくわかっていません。別な可能性としてリガンドは無く、接着タンパク質を補強する働きをしている可能性があります。これらを解明し、応用することで、再生した神経軸索を思いのままの深さの層にまで到達させ安定化を図ることができるかもしれません。例えば、一度損傷した神経回路の機能を回復させられる可能性があります。
用語説明
[用語1] 神経軸索 : 神経細胞の出力を担う突起。通常細胞1つに1本存在し、電気コードのような役目を担う。
[用語2] 受容体型チロシン脱リン酸化酵素 : 膜タンパク質で、細胞の表面に位置しており、細胞外部からのシグナルを受け取って、細胞内部のリン酸化されたタンパク質を脱リン酸化することによって細胞内部に変化をもたらすシグナル分子である。このファミリーに属する同族タンパク質が多数存在している。
[用語3] 細胞内ドメイン : 膜貫通型タンパク質の細胞内に突き出した部分。通常、細胞外ドメインが受け取ったシグナルを細胞内に伝達する機能を有する。
[用語4] リガンド : 受容体に結合するシグナル分子の一般名称。細胞外から作用する。
論文情報
掲載誌 : |
eLife |
論文タイトル : |
Two receptor tyrosine phosphatases dictate the depth of axonal stabilizing layer in the visual system |
著者 : |
Satoko Hakeda-Suzuki, Hiroki Takechi, Hinata Kawamura, Takashi Suzuki |
DOI : |
お問い合わせ先
東京工業大学 生命理工学院 生命理工学系
鈴木崇之 准教授
E-mail : suzukit@bio.titech.ac.jp
Tel : 045-924-5796 / Fax : 045-924-5974
取材申し込み先
東京工業大学 広報・社会連携本部 広報・地域連携部門
E-mail : media@jim.titech.ac.jp
Tel : 03-5734-2975 / Fax : 03-5734-3661