東工大ニュース
東工大ニュース
公開日:2019.04.01
東京理科大学 理工学部 応用生物科学科 田口速男教授および中島将博講師、東京工業大学 理学院 化学系 宮永顕正助教らのグループは、天然では希少な多糖である“β-1,2-グルカン”を内部より加水分解する、真核生物由来のβ-1,2-グルカナーゼを初めて単離同定することに成功し、そのアミノ酸配列、機能および立体構造から糖加水分解酵素の新規なファミリーを創設しました。また、本酵素が既知の糖加水分解酵素とは異なるユニークな反応機構をもつことも明らかにしました。
本研究成果はThe Journal of Biological Chemistry誌に3月29日付け(米国東部時間)で掲載されました。
β-1,2-グルカンとは一部の共生細菌や病原性細菌が合成・分泌する多糖であり、宿主への共生や感染、また細胞内浸透圧の調節物質として知られています([参考論文1]、[参考論文2])(図1A)。また、環状β-1,2-グルカンの誘導体は合成フラボノイド(ビタミン様物質)の一種の水溶性を非常に向上させることが報告されています[参考論文3]。天然では希少とされていますが、近年、当グループにより直鎖状β-1,2-グルカンの人工的な(酵素法による)大量調製法が確立され[参考文献4]、β-1,2-グルカンに作用する関連酵素の探索が容易になりました。
β-1,2-グルカンを内部より加水分解するβ-1,2-グルカナーゼ(SGL)はそのうちの一つであり、2017年に原核生物由来SGL(CpSGL)の単離及び同定が行われ、新規な糖加水分解酵素(GH)のファミリー[用語1](GH144)が創設されています[参考文献5]。しかし、真核生物にもβ-1,2-グルカン分解活性を示す微生物が報告[参考文献6]されているにもかかわらず、CpSGLの近縁酵素の中には真核生物由来のものは全く見出されませんでした。そのため、真核生物と原核生物ではSGLの起源が異なると考えられます。
唯一の炭素源として大量調製された直鎖状β-1,2-グルカンを用いて、培養液上清中にβ-1,2-グルカン分解活性が認められる糸状菌Talaromyces funiculosusからSGL(TfSGL)の精製・単離を行いました。本酵素の遺伝子同定により判明した全アミノ酸配列から近縁酵素を系統的に検索したところ、既知のGHは全く見出されませんでした(図1B)。また、これら近縁酵素のほとんどは真核生物由来のものであり、粘菌や子のう菌に機能未知タンパク質として分布していました。したがって、本酵素は、これらの機能未知タンパク質とともに、新規GHファミリーを構成していることが示唆されました。
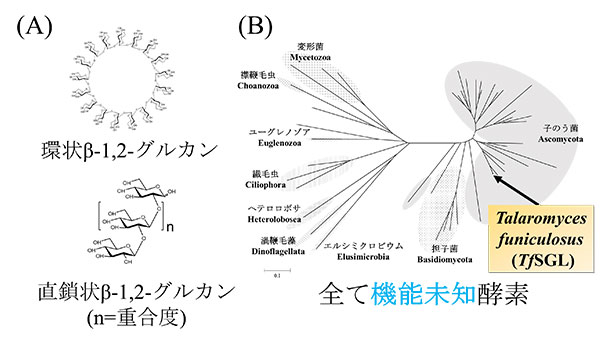
図1. β-1,2-グルカンの構造(A)とTfSGLの系統樹(B)
(B)TfSGL及びその近縁タンパク質の中に、既知のGHは全く見出されませんでした。また、近縁タンパク質のほぼ全てが真核生物由来のタンパク質でした。
酵母を宿主とした組換え型TfSGL(TfSGLr)は、天然型酵素と同様にβ-1,2-グルカンに対して特異的な分解活性を発揮しました。さらに生化学的な機能解析から、本酵素が基質内部から分解を行うendo型[用語2]の分解活性を示すこと、アノマー反転型[用語3] の反応機構を持つこと、5糖以上のβ-1,2-グルコオリゴ糖(Sopns、nは結合したグルコースの分子数を示す)に作用し、その還元末端から主にSop2を遊離することも明らかになりました。
本酵素には立体構造既知の近縁酵素がありません。そこで、ヨウ素の異常分散効果を利用して位相決定を行い、(α/α)6 toroid foldの全体構造を有するTfSGLrの立体構造の決定に成功しました。さらに、本酵素の触媒機構および基質認識機構を解明するために、非活性型変異体E262Q(262番目のグルタミン酸をグルタミンに置換した変異体)とβ-1,2-グルカンを用いてミカエリス複合体構造[用語4] を構造解析から取得しました(図2)。
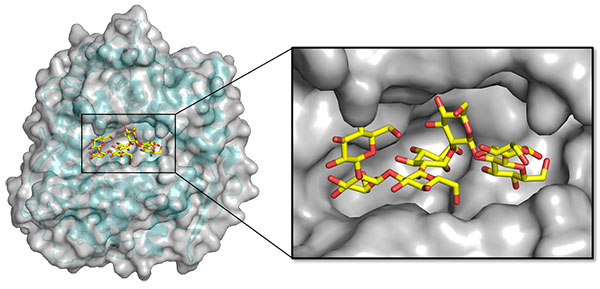
図2. TfSGL-β-1,2-グルカン複合体の全体構造及び基質ポケット構造
クレフト状の基質ポケットにしっかりと基質が結合していました。
GH酵素において一般的なアノマー反転型の反応機構では、切断部位へ直接プロトン供給可能な距離と求核水を直接活性化可能な距離に酸性残基(それぞれ一般酸触媒、一般塩基触媒)が存在します[参考文献7]。しかし、大変興味深いことに、本酵素にそのような残基は見出されませんでした。そこで、切断点近傍に位置するすべての触媒候補アミノ酸残基に対して部位特異的置換変異体を作成し、それらのβ-1,2-グルカンに対する活性を調べたところ、E262、D177(一般酸触媒候補)及びD446(一般塩基触媒候補)の3変異体に顕著な活性低下が認められました。D446はβ-1,2-グルカンとの複合体構造中において、求核水とは別の水分子を介して求核水と相互作用可能な距離に存在していることから、この残基が一般塩基触媒である可能性が強く示唆されました。一方で、D177及びE262は、それぞれ基質自身の別々な3位ヒドロキシ基を介して基質の切断部位の酸素原子と相互作用しており、これらのいずれかが一般酸触媒としてはたらくことが示唆されました。
そこで、D177及びE262のどちらが一般酸触媒かを決定するために、各々の残基と相互作用する3位ヒドロキシ基の酸素原子を除去した(各残基から基質の切断部位への作用が遮断された)基質誘導体に対する分解活性を調べました。その結果、E262と相互作用するヒドロキシ基が還元された基質のみで分解が認められませんでした(図3)。この結果は、E262が基質の3位ヒドロキシ基を介して一般酸触媒残基として機能することを示しており、本酵素が触媒機構の上でも新規な特徴をもつことが明らかになりました(図4)。
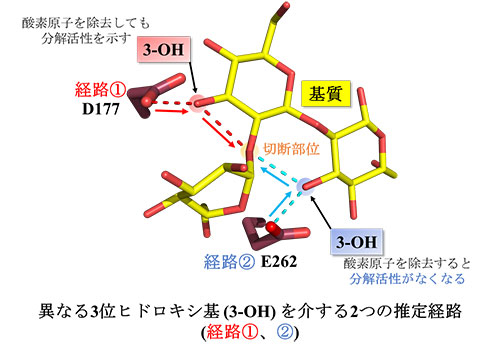
図3. 推定されたTfSGLの一般酸触媒経路
構造解析より推定された基質の3位ヒドロキシ基(3-OH)を介して行われる触媒経路。赤色は酸素原子を表します。基質の3位ヒドロキシ基の酸素原子を還元して除去すると触媒経路が遮断されました。
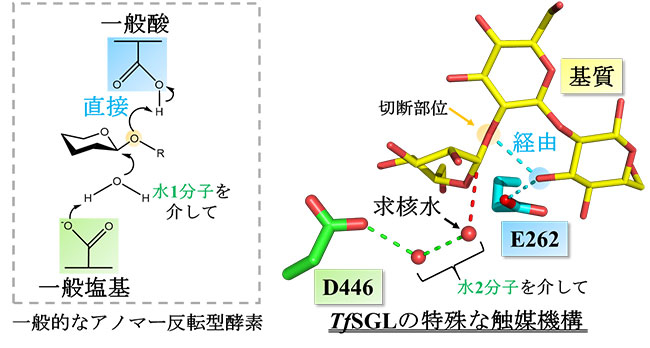
図4. 本研究により明らかになったTfSGLの触媒機構
基質の一部を介して作用する一般酸触媒及び求核水とは別の水分子により求核水を活性化させる触媒反応を行う一般塩基触媒。いずれにおいても、TfSGLの反応機構は一般的なアノマー反転型酵素とは異なるものでした。
β-1,2-グルカン関連酵素の研究は、基質の大量合成法確立を皮切りに、近年急速に進展しています。本研究により報告した真核生物由来SGLに関する知見は、原核生物由来SGLと真核生物由来SGL間での分子進化を明らかにするための一助となり、新規なβ-1,2-グルカン関連酵素を発見するために役立つと考えられます。また、真核生物由来SGLは共生、または寄生を行う菌に多く存在することから、本酵素や、その近縁酵素は真核生物の共生や寄生に何らかの関わりをもっているかもしれません。
さらに、TfSGLの触媒機構は一般的な反転型酵素のものとは一般酸及び一般塩基触媒の両者において異なる非常に特殊なものでした。いずれか一方が異なるGH酵素は稀に報告されていますが、両者とも異なるものは本酵素が初めてです。本研究成果の知見は、他のGH酵素群のまだ見つかっていない多様な反応機構の推定や解析やTfSGLと同様の反応機構をもつ新規な酵素の発見につながると考えられます。
用語説明
[用語1] GHファミリー : GHは、基本的に酵素のアミノ酸配列によって分類され、CAZy(Carbohydrate-Active enZYmes Database)には161のファミリー(2019年3月22日現在)が設立されています。しかし、非常に多種多様な糖鎖に対して非常に数が少なく、今後も新規なファミリーが発見されていくと考えられます。
[用語2] endo型 : ポリマー基質の末端からではなく、内部から加水分解を行う分解様式のことです。末端のない基質(環状基質)に対しても活性を示すことが可能です。
[用語3] アノマー反転型酵素 : 図4(左)で示した基質のアノマー位のヒドロキシ基の向きが反応産物で反転する酵素のことです。一般的には2つの酸性アミノ酸残基がそれぞれ一般酸触媒および一般塩基触媒として働きます。この触媒機構では、切断部位近傍に存在する一般酸触媒が直接グリコシド結合中の酸素原子をプロトン化します。同時に、一般塩基触媒が求核攻撃を行う水分子(求核水)を活性化し、求核水がアノマー位炭素原子に求核攻撃することにより分解が生じます。
[用語4] ミカエリス複合体 : 酵素が基質に結合し、反応が生じる直前の複合体構造を表します。
参考論文
[1] Dylan, T., Ielpi, L., Stanfield, S., Kashyap, L., Douglas, C., Yanofsky, M., Nester, E., Helinski, D. R. and Ditta, G.(1986)Rhizobium meliloti genes required for nodule development are related to chromosomal virulence genes in Agrobacterium tumefaciens. Proc. Natl. Acad. Sci. U. S. A. 83, 4403–4407.
[2] Rigano, L. A., Payette, C., Brouillard, G., Marano, M. R., Abramowicz, L., Torres, P. S., Yun, M., Castagnaro, A. P., Oirdi, M. E., Dufour, V., Malamud, F., Dow, J. M., Bouarab, K. and Vojnov, A. A.(2007)Bacterial cyclic β-(1,2)-glucan acts in systemic suppression of plant immune responses. Plant Cell 19, 2077–2089.
[3] Piao, J., Janga, A., Choi, Y., Tahir, M. N., Kim, Y., Park, S., Cho, E. and Jung, S. Solubility enhancement of α-naphthoflavone by synthesized hydroxypropyl cyclic-(1→2)-β-D-glucans(cyclosophoroases)(2014)Carbohydr Polym. 101, 733-740.
[4] Abe, K., Nakajima, M., Kitaoka, M., Toyoizumi, H., Takahashi, Y., Sugimoto, N., Nakai, H. and Taguchi, H.(2015)Large-scale preparation of 1,2-β-glucan using 1,2-β-oligoglucan phosphorylase. J. Appl. Glycosci. 62, 47–52.
[5] Abe, K., Nakajima, M., Yamashita, T., Matsunaga, H., Kamisuki, S., Nihira, T., Takahashi, Y., Sugimoto, N., Miyanaga, A., Nakai, H., Arakawa, T., Fushinobu, S. and Taguchi, H.(2017)Biochemical and structural analyses of a bacterial endo-β-1,2-glucanase reveal a new glycoside hydrolase family. J. Biol. Chem. 292, 7487–7506.
[6] Reese, E. T., Parrish, F. W. and Mandels, M.(1961)β-D-1,2-Glucanases in fungi. Can. J. Microbiol. 7, 309–317.
[7] Davies, G. and Henrissat, B.(1995)Structures and mechanisms of glycosyl hydrolases. Structure 3, 853–859.
論文情報
掲載誌 : |
The Journal of Biological Chemistry |
論文タイトル : |
Identification, characterization and structural analyses of a fungal endo-β-1,2-glucanase reveal a new glycoside hydrolase family |
著者 : |
Nobukiyo Tanaka, Masahiro Nakajima, Megumi Narukawa-Nara, Hiroki Matsunaga, Shinji Kamisuki, Hiroki Aramasa, Yuta Takahashi, Naohisa Sugimoto, Koichi Abe, Tohru Terada, Akimasa Miyanaga, Tetsuro Yamashita, Fumio Sugawara, Takashi Kamakura, Shiro Komba, Hiroyuki Nakai and Hayao Taguchi |
DOI : |
お問い合わせ先
東京理科大学 理工学部 応用生物科学科
講師 中島将博
E-mail : m-nakajima@rs.tus.ac.jp
Tel : 0471-24-1501
取材申し込み先
東京理科大学 研究戦略・産学連携センター(URAセンター)
E-mail : ura@admin.tus.ac.jp
Tel : 03-5228-7440
東京工業大学 広報・社会連携本部 広報・地域連携部門
E-mail : media@jim.titech.ac.jp
Tel : 03-5734-2975 / Fax : 03-5734-3661