東工大ニュース
東工大ニュース
公開日:2020.07.27
東京工業大学 生命理工学院 生命理工学系の中戸川仁准教授、持田啓佑研究員(研究当時。現・理化学研究所脳神経科学研究センター 基礎科学特別研究員)および微生物化学研究所の野田展生部長、山﨑章徳博士研究員(研究当時。現・東京工業大学 科学技術創成研究院 特任助教)らの研究グループは、小胞体[用語1]がオートファジーによって分解される過程で起こる、小胞体膜の局所的変形の分子基盤を明らかにした。
オートファジーは細胞内の分解機構であり、細胞質のタンパク質や核酸、細胞小器官などをオートファゴソーム[用語2]と呼ばれる「袋」に入れて、分解の場であるリソソームや液胞に輸送する。細胞小器官である小胞体は、栄養飢餓などの特定の状況下ではオートファジーによって積極的に分解されるが(ERファジー)、小胞体をオートファゴソームに積み込む分子メカニズムは不明であった。
本研究では、ERファジーのレセプタータンパク質Atg40に脂質膜を折り曲げる性質があることを発見した。また小胞体上でAtg40が形成途中のオートファゴソーム上のAtg8という別のタンパク質との結合を介して多量体化することで、小胞体膜が局所的に変形され、オートファゴソームに効率的に積み込まれることを明らかにした。さらにX線結晶構造解析から、ERファジーのレセプタータンパク質に保存されたAtg8とのユニークな結合様式を解明した。
この研究成果は、英国科学誌「Nature Communications」で2020年7月3日に公開された。
小胞体は、細胞内に存在する最大の膜構造体であり、分泌タンパク質や膜タンパク質の合成をはじめとした必須の細胞機能を数多く担っている。小胞体の「量」と「品質」を適切に保つことは、外部環境への適応や細胞死の回避に重要であり、小胞体が「過剰」あるいは「異常」となったときには、その一部を適切に除去する必要がある。
最近の研究から、オートファジーによって小胞体の一部を積極的に分解する現象(ERファジー)の存在が明らかになってきた。オートファジーは、細胞内の成分を分解する仕組みの一つであり、オートファゴソームと呼ばれる脂質膜の袋が細胞質の一部を包み込み、分解に特化したコンパートメント(リソソーム/液胞)との融合により内容物を分解する。ERファジーでは、小胞体上に分解の目印となる「レセプタータンパク質」が提示されると、形成途中のオートファゴソーム膜上のタンパク質「Atg8」がレセプタータンパク質に結合し、小胞体の一部がオートファゴソームに包み込まれる。この過程において、連続した単一の膜構造と考えられている小胞体の一部をオートファゴソームに隔離するためには、分解する小胞体領域を「切り離す」必要がある。しかし、この小胞体の切り離しがどのようにして行われるのか、切り離しがオートファゴソーム形成と共役して起こるのかなど、その分子メカニズムには多くの謎が残されていた。またこれまでの研究で、小胞体断片が複雑に折りたたまれるようにしてオートファゴソームに隔離されている様子が観察されていたが、細胞内で網状に広がる小胞体をオートファゴソームへ効率的に「詰め込む」メカニズムも不明であった。
本研究グループは、モデル生物「出芽酵母[用語3]」を用いて、ERファジーの分子メカニズムについて研究を進めてきた。同グループは過去に、出芽酵母では「Atg40」がERファジーのレセプターとして機能することを明らかにしている。本研究においてAtg40の細胞内動態を解析した結果、Atg40は、オートファゴソームの形成開始とともに、その近傍にある小胞体上に集積した。その後、オートファゴソーム形成と共役する形で小胞体領域の一部が切り離されることがわかった。さらにAtg40が、ヘアピン状に脂質膜に挿入されるドメインを持ち、このドメインを介して脂質膜を折り曲げる性質を持つこと、この領域が小胞体膜の切り離しに重要であることを明らかにした(図1A)。
さらにAtg40は、形成途中のオートファゴソーム膜上のAtg8との多価的な相互作用によって多量体化し、高次集積することが強く示唆された。Atg40の多量体化を人為的に誘導すると、小胞体膜が球状に濃縮された構造体が形成されたが、この構造の形成には脂質膜の折り曲げに関わる領域が必須であった(図1B、C)。すなわち、形成途中のオートファゴソームと接する小胞体領域においてAtg40が多量体化することで、その小胞体領域が局所的に折りたたまれ、凝縮された状態でオートファゴソームに積み込まれると考えられる(図1C)。本研究により、レセプターであるAtg40が、オートファゴソーム膜と小胞体膜とを繋ぎとめる役割だけでなく、分解する小胞体領域を折りたたみ、オートファゴソームに効率よく詰め込むための重要な役割も果たすことが明らかになった。
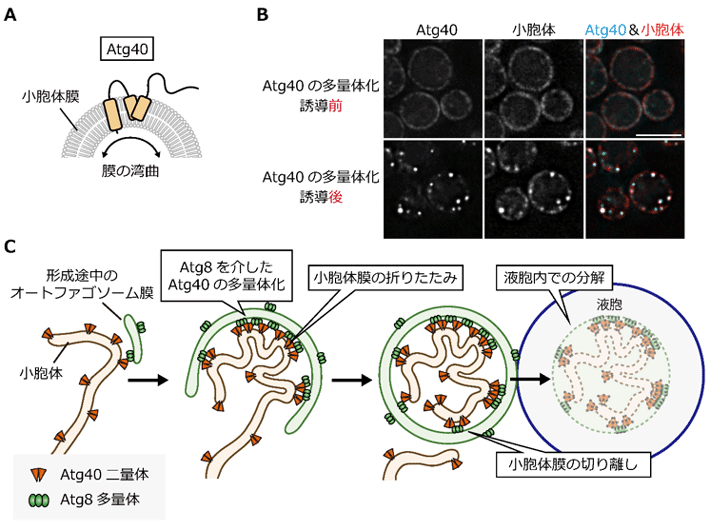
図1. Atg40の多量体化を介した小胞体の局所的な折りたたみ
(A)Atg40はヘアピン状に脂質膜に入り、膜を折り曲げる性質を持つ
(B)Atg40の多量体化を誘導すると、小胞体膜が球状に凝縮された構造が形成される
(C)Atg40を介したERファジーの分子メカニズムのモデル
また本研究では、Atg40とAtg8の相互作用の構造基盤を明らかにした。レセプタータンパク質は、Atg8-familly interacting motif(AIM)と呼ばれる共通のモチーフ配列を介してAtg8と結合することが知られている。Atg40の場合には、これまでに報告されてきた多くのレセプターとは異なり、AIMに加えて、近傍のαヘリックス構造がAtg8との結合をサポートするというというユニークな結合様式の存在が明らかになった(図2)。さらに、このAtg8との特徴的な結合様式は、哺乳動物の3つのERファジーレセプターにも見られることもわかった。
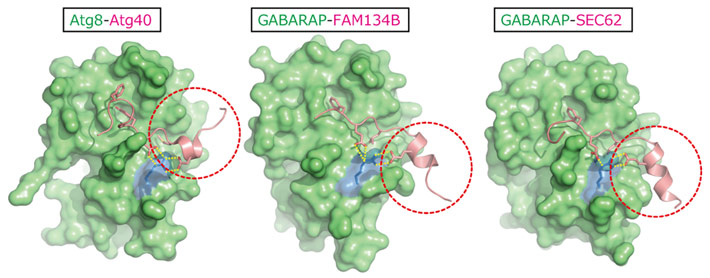
図2. ERファジーのレセプターに保存されたAtg8との結合様式
3つの図はそれぞれ、ERファジーレセプター(Atg8結合領域のみ)とAtg8の複合体の結晶構造を表す。GABARAPは哺乳動物のAtg8ホモログ、FAM134BおよびSEC62は哺乳動物におけるERファジーレセプターである。赤点線はAtg8との結合をサポートするヘリックス構造を示す。
哺乳動物において、ERファジーの破綻は神経細胞の細胞死による自律感覚神経障害を引き起こすと考えられている。ERファジーの分子メカニズムを理解することは、同疾患の発症機構を理解するうえでも重要である。本研究によって、巨大な小胞体の一部を直径500 nm程度のオートファゴソームに効率よく積み込み、切り離すという、複雑なプロセスのメカニズムの一端が明らかになった。しかしながら、小胞体の切り離しを直接媒介する因子が他にも存在するのかどうかなど、未解明の点も残されている。
本研究で明らかにした、ERファジーのレセプタータンパク質に保存されているAtg8とのユニークな結合様式は、選択的なオートファジーの構造面の理解に新たな知見を与えるものである。ERファジーのレセプターに特徴的なAtg8との結合様式が、酵母からヒトまでの幅広い種で高度に保存されている理由は興味深い謎であり、今後の解明が期待される。
用語説明
[用語1] 小胞体 : 細胞内に網状に広がる最大の細胞小器官。タンパク質や脂質の合成・輸送、カルシウムイオンの貯蔵、他のオルガネラとの接触部位の形成など、その機能は多岐に渡る。小胞体へのストレスの蓄積は細胞死を引き起こす。
[用語2] オートファゴソーム : 栄養飢餓などのストレスに応じて形成される二重膜構造。膜胞がカップ状に伸張し、閉じることで細胞質の一部を隔離する。
[用語3] 出芽酵母 : 単細胞の真核生物であり、基本的な細胞の構造や生命現象は哺乳動物細胞と共通している。遺伝学的操作の容易さなどから、オートファジーをはじめ様々な生命現象の研究に先導的な役割を果たしてきたモデル生物。
論文情報
掲載誌 : |
Nature Communications |
論文タイトル : |
Super-assembly of ER-phagy receptor Atg40 induces local ER remodeling at contacts with forming autophagosomal membranes |
著者 : |
Keisuke Mochida, Akinori Yamasaki, Kazuaki Matoba, Hiromi Kirisako, Nobuo N. Noda, Hitoshi Nakatogawa |
DOI : |
お問い合わせ先
東京工業大学 生命理工学院 生命理工学系
准教授 中戸川仁
E-mail : hnakatogawa@bio.titech.ac.jp
Tel : 045-924-5735 / Fax : 045-924-5743
微生物化学研究所 構造生物学研究部
部長 野田展生
E-mail : nn@bikaken.or.jp
Tel : 03-3441-4173 / Fax : 03-3441-7589
取材申し込み先
東京工業大学 総務部 広報・社会連携課
E-mail : media@jim.titech.ac.jp
Tel : 03-5734-2975 / Fax : 03-5734-3661
微生物化学研究会 微生物化学研究所 知的財産情報室
E-mail : office@bikaken.or.jp
Tel : 03-3441-4173 / Fax : 03-3441-5811