東工大ニュース
東工大ニュース
公開日:2021.04.20
東京工業大学 物質理工学院 応用化学系の田中克典教授(理化学研究所(理研)開拓研究本部田中生体機能合成化学研究室 主任研究員)、アンバラ・プラディプタ助教(同客員研究員)らの共同研究チーム※は、がん細胞で特異的かつ大量に産生される「アクロレイン」という分子(CH2=CHCHO)を利用して、抗がん剤を体内のがん細胞でのみ効率的に放出する治療技術を開発しました。
本研究成果は、がんに対する副作用のない化学療法の開発に貢献すると期待できます。
がんの化学療法に用いられる抗がん剤は、体内で選択的にがんに届けない限り正常細胞にも作用するため、それがさまざまな副作用につながるという問題があります。
今回、共同研究チームは、がん細胞内でアジド基(−N3)を持つフェニルアジドという化合物とアクロレインが選択的に環化付加反応を起こすことを利用した「プロドラッグ[用語1]」を設計しました。プロドラッグは生体内における化学反応により、標的部位(がん細胞)にのみ効果を示す薬剤です。設計したプロドラッグを、がんを発症したマウスに注射投与したところ、がん組織のみで抗がん活性分子のマイトマイシンCが放出され、がんを治療することに成功しました。副作用は全く見られず、治療後の再発も起こりませんでした。
本研究は、科学雑誌『Chemical Science』のオンライン版(4月1日付:日本時間4月1日)に掲載されました。
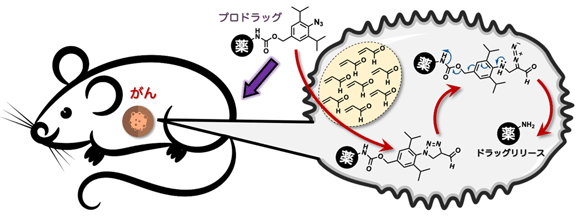
図1. アジド−アクロレイン環化付加反応により、マウスのがん組織で抗がん活性分子を放出する
がんは、世界的に主要なヒトの死因の一つです。先進国では、特に肺がん、乳がん、前立腺がんの割合が多い傾向にあります。がんの治療法には大きく分けて、手術療法、化学療法、免疫療法、放射療法の四つがあります。臨床の現場では、がんの種類、病期、体の状態などを考慮して適切な治療法が選択され、二つ以上の治療法を組み合わせる場合もあります。化学療法は抗がん剤を用いて再発や転移を防ぐことを目的とした治療で、有用な治療モダリティ[用語2]です。
抗がん剤を体内に入れると、がん組織だけでなく正常な細胞、特に細胞分裂が盛んな骨髄細胞や消化管細胞にも影響を及ぼすため、それがさまざまな副作用となって現れます。正常細胞への影響を減らし、副作用を最小限に抑えるには、抗がん剤を選択的にがん組織に送達する必要があります。
これまでに田中克典主任研究員らは、がん細胞において「アクロレイン」という分子(CH2=CHCHO)が特異的かつ大量に産生されていることを発見し、蛍光基を結合させたフェニルアジドを用いることにより、体内においてがん細胞を選択的に標識できることを見いだしていました。この方法は現在、乳がんの術中診断法を改革する技術として臨床研究が行われています注1)。今回、共同研究チームはアクロレインと反応することで効率的に抗がん剤を放出する「プロドラッグ」をデザインし、副作用のない「生体内合成化学治療」の実現を目指しました。
共同研究チームは、低濃度な条件でアジド基(−N3)とアクロレインの環化付加反応が進行するように、アクロレインに対する反応性が高い2,6-ジイソプロピルフェニルアジドを用いることにしました。そして、アジド基のパラ位にカルバメート(カルバミン酸エステル)を導入し、抗がん活性分子の一例としてマイトマイシンCと架橋した「プロドラッグ1」を設計しました(図2)。プロドラッグ1はがん細胞が産生するアクロレインと環化付加反応を起こした後、自発的にジアゾ化合物へと変化します。すると、架橋部分のカーバメートが切断される反応が起こり、マイトマイシンCが放出されます。
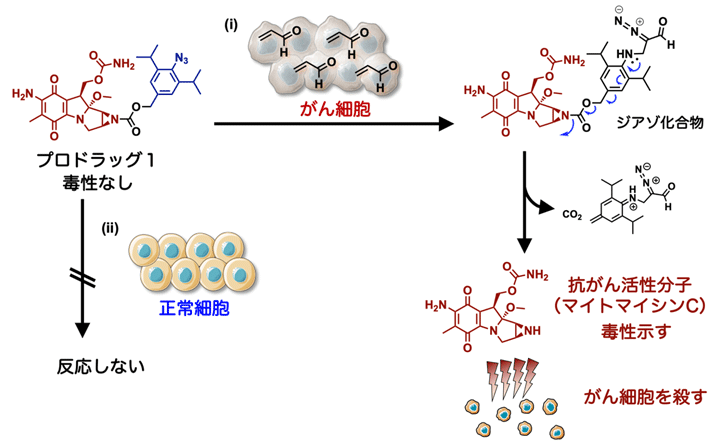
図2. アジド基とアクロレインの環化付加反応によるプロドラッグ1のデザイン
プロドラッグ1は、抗がん活性分子のマイトマイシンC(茶線部分)と2,6-ジイソプロピルフェニルアジド(青線部分)をカルバメート(カルバミン酸エステル、黒線部分)が架橋した構造をしている。プロドラッグ1をがん細胞に作用させると、アジド基(−N3)とがん細胞が産生するアクロレインが環化付加反応を起こし、ジアゾ化合物となる。ジアゾ化合物では青矢印で示す反応が起こり、架橋部分のカーバメートが切断され、マイトマイシンCが放出される。放出されたマイトマイシンCはがん細胞を死滅させる(i)。一方、プロドラッグ1は正常細胞とは反応しない(ii)。
共同研究チームはまず、設計したプロドラッグ1の細胞に対する毒性効果を調べるために、正常細胞(MCF10A)、ヒト肺がん細胞(A549)、ヒト子宮頸がん細胞(HeLa S3)に、マイトマイシンCおよびプロドラッグ1をそれぞれ作用させる毒性試験を行いました(図3)。その結果、マイトマイシンCは3種類の細胞全てに対して強い毒性を示した一方、プロドラッグ1は正常細胞には毒性を示さず、がん細胞で選択的に発生するアクロレインと反応して毒性を示すことが分かりました。
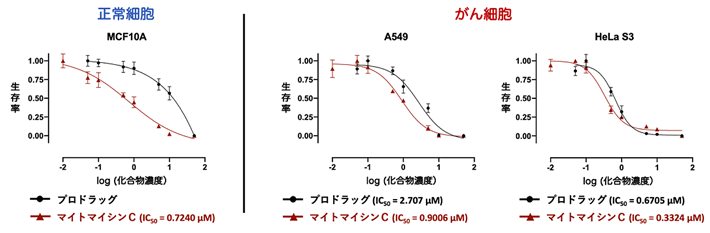
図3. プロドラッグ1 およびマイトマイシンCの毒性試験
マイトマイシンC(茶線)は正常細胞、2種類のがん細胞(A549およびHeLa S3)の全てに毒性を示した。一方、プロドラッグ1(黒線)は正常細胞には毒性を示さなかったが、2種類のがん細胞には毒性を示した。IC50は50%阻害濃度のことで、数字が小さいほど阻害効果(毒性)が大きいことを示す。
次に、プロドラッグ1の治療効果を調べるために、A549肺がん細胞を移植したxenograft モデルマウス[用語3]を3群に分け、各腫瘍内に3日1回、10日間にわたりフェニルアジド(対照群)、マイトマイシンC、プロドラッグ1をそれぞれ注射投与し、腫瘍の成長を比較しました(図4)。その結果、対照群では腫瘍の成長が抑制されず、腫瘍が著しく大きくなり、32日目には死亡することが分かりました。一方、臨床研究で推奨されている量のマイトマイシンCを投与した群では、腫瘍の成長は著しく抑制されましたが、危篤な副作用により、著しい体重減少や全身の炎症が起こりました。この結果、10日目には全てのマウスが死亡しました。
一方、マイトマイシンCと同じ量のプロドラッグ1を投与した群では、高いがん治療効果を確認できました。腫瘍の成長が抑えられただけではなく、治療終了後も再発は見られませんでした。また、治療期間中、マウスの体重は維持され、炎症などの副作用も全く生じなかったことから、治療後2ヵ月経っても生存し続けることが確認できました。このように体内のがん細胞が生成するアクロレインとプロドラッグ1が反応することで、マイトマイシンCががん組織のみで放出され、効果的ながん化学療法を実現しました。
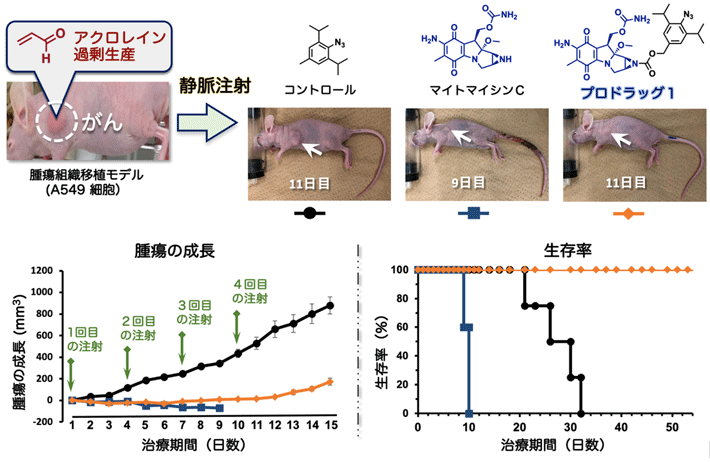
図4. 肺がん移植マウスの腫瘍内注射によるがん治療実験
フェニルアジドを投与した対照群(黒)では、腫瘍が著しく大きくなり、26日目の生存率は50%、32日目には0%になった。マイトマイシンCを投与した群(青)では、腫瘍の成長は抑制できたものの、 危篤な副作用のため10日目で全てのマウスが死亡した。プロドラック1を投与した群(オレンジ)では、腫瘍の成長が抑制されるとともに副作用も見られず、50日目でも生存率は100%であった。
本研究では、アクロレインという生体内分子に着目し、アクロレインが多量に産生されるがん細胞内で選択的に有機合成反応を行うという画期的な視点で研究を進め、副作用のない新しい生体内合成化学治療法の開発に成功しました。アクロレインはほとんどの種類のがん細胞において産生されており、実際に共同研究チームは、アクロレインを指標として乳がん術中診断の臨床研究に成功しています。今後、アクロレインを診断だけでなく治療のツールとしても展開することで、さまざまながんの化学療法に大きく貢献すると期待できます。

左からアンバラ・プラディプタ、六車共平、田中克典、寺島一輝、藤井素子
用語説明
[用語1] プロドラッグ : 生体内の薬剤標的部位での化学反応によって、薬効を示す分子に変換されるようにデザインされた薬剤。標的部位選択的に活性を示すことから副作用の軽減が期待できる。標的部位での化学反応には、生体内の酵素による触媒反応や生体内の低分子との反応が主に用いられる。また、近年は生体内に導入した遷移金属触媒によって分子の変換を行う研究も進められている。
[用語2] 治療モダリティ : 低分子や中分子化合物(薬)、抗体医薬、核酸医薬、細胞医薬、再生医薬、遺伝子治療など、さまざまな新しい創薬基盤技術を活用した治療手段・医薬品のこと。
[用語3] Xenograft モデルマウス : ヒト由来のがん細胞を免疫不全マウス(免疫に欠陥があるマウス)へ移植したモデル。
論文情報
掲載誌 : |
Chemical Science |
論文タイトル : |
Targeted 1,3-dipolar cycloaddition with acrolein for cancer prodrug activation |
著者 : |
Ambara R. Pradipta, Peni Ahmadi, Kazuki Terashima, Kyohei Muguruma, Motoko Fujii, Tomoya Ichino, Satoshi Maeda, and Katsunori Tanaka |
DOI : |
お問い合わせ先
東京工業大学 物質理工学院 応用化学系
教授 田中克典
(理化学研究所 開拓研究本部 田中生体機能合成化学研究室 主任研究員)
E-mail : kotzenori@riken.jp
Tel : 048-467-9405 / Fax : 048-467-9379
取材申し込み先
理化学研究所 広報室 報道担当
E-mail : ex-press@riken.jp
東京工業大学 総務部 広報課
E-mail : media@jim.titech.ac.jp
Tel : 03-5734-2975 / Fax : 03-5734-3661