東工大ニュース
東工大ニュース
公開日:2021.06.22
東京工業大学 生命理工学院 生命理工学系の刑部祐里子教授は、徳島大学大学院社会産業理工学研究部 刑部敬史教授および近畿大学生物理工学部 宮下尚之准教授らと共同で、このたび、世界で初めて、サブタイプType I-Dに属するCRISPR-Casがヒト細胞においてゲノム編集に活用できることを実証しました。今回の成果により、海外特許に抵触することなく、ゲノム編集技術の創薬や医療分野への応用が可能になると期待できます。
近年、ゲノム上の特定のDNA配列を特異的かつ効率的に変異を導入できる技術としてゲノム編集技術の開発が進んでいます。ゲノム編集による遺伝子改変は、遺伝子の機能解明など基礎研究の発展だけでなく、遺伝子治療や再生医療などの医療分野、新薬の開発などの創薬分野、植物、家畜の品種改良などの農林水産業分野など、幅広い分野での応用、活用が期待されています。ゲノム編集技術の中でも、微生物の獲得免疫システムの一つであるCRISPR-Cas9システムを活用した技術は、その簡便さと高効率性から最も広く利用されており、共同開発者であるジェニファー・ダウドナ博士とエマニュエル・シャルパンティエ博士が昨年ノーベル化学賞を受賞したことも記憶に新しいところです。
一方で、課題としては、意図しない配列へと変異を導入してしまうオフターゲット効果が生じる可能性や、標的配列の選択性の制限などが挙げられています。また、ゲノム編集技術はほとんどが欧米で開発された技術であるため、国内の産業・医療での活用をする際には知的財産の問題が生じる、という問題点があることから、新しい国産ゲノム編集技術の開発が望まれていました。これまで、徳島大学大学院社会産業理工学研究部の刑部敬史教授・刑部祐里子教授(当時)らのグループは、自然界に存在する多様なCRISPR-Casシステムの中から、機能未知であったCRISPR-Cas type I-Dシステムを同定し、新規ゲノム編集ツールTiDとして開発、植物でのゲノム編集の成功を報告していました(Osakabe et al., 2020)。
このたび、刑部祐里子教授らの研究グループは、TiDの構成タンパク質の中でもCas10dタンパク質がDNAを切断するヌクレアーゼとして機能することを明らかにし、さらにTiDシステムを用いたヒト細胞でのゲノム編集に成功しました。今回の成果により、海外特許に抵触することなく、ゲノム編集技術の創薬や医療分野への応用が可能になると期待できます。また、TiDはCas9よりも長い配列を認識することから(Cas9は20塩基を認識するのに対し、TiDは35, 36塩基を認識する)、狙った配列のみを改変する、より特異的なゲノム編集が可能になると期待できます。
TiDシステムは、5つのCasタンパク質(Cas3d、Cas5d、Cas6d、Cas7d、Cas10d)と35-36 bpの標的配列を認識するガイドRNAから構成されます(図1)。そのなかでもCas10dは、他のCRISPR-Casシステムにはない、TiDシステムにユニークなタンパク質ですが、その機能はまだ明らかではありませんでした。本研究で、刑部、和田らは、試験管内でCas10dがヌクレアーゼ活性を持つこと(図2)、またCas10dとCas3dがDNAの巻き戻しに関連すると考えられるATPase活性を持つこと、ヒト細胞内でCas10dが他のCasタンパク質から構成される複合体へとCas3dをリクルートするために必要であること等を明らかにしました。また、分子動力学シミュレーションによって、ガイドRNAとCasタンパク質との複合体形成に重要なCas7d内のアミノ酸残基も明らかにしました。さらに、ゲノム編集の利用にあたって重要な情報である変異導入の特異性を明らかにするため、標的配列とミスマッチを持つガイドRNAを設計し、レポーターアッセイによってその影響を解析しました。その結果、ミスマッチの位置にもよりますが、1塩基のミスマッチでも活性に大きな影響を与えることを明らかにしました。これらの結果により、TiDがオフターゲット変異のリスクを低減する高い特異性を持つこと、TiDが既報のシステムとは異なるユニークなメカニズムを持つシステムであることが明らかにしました。
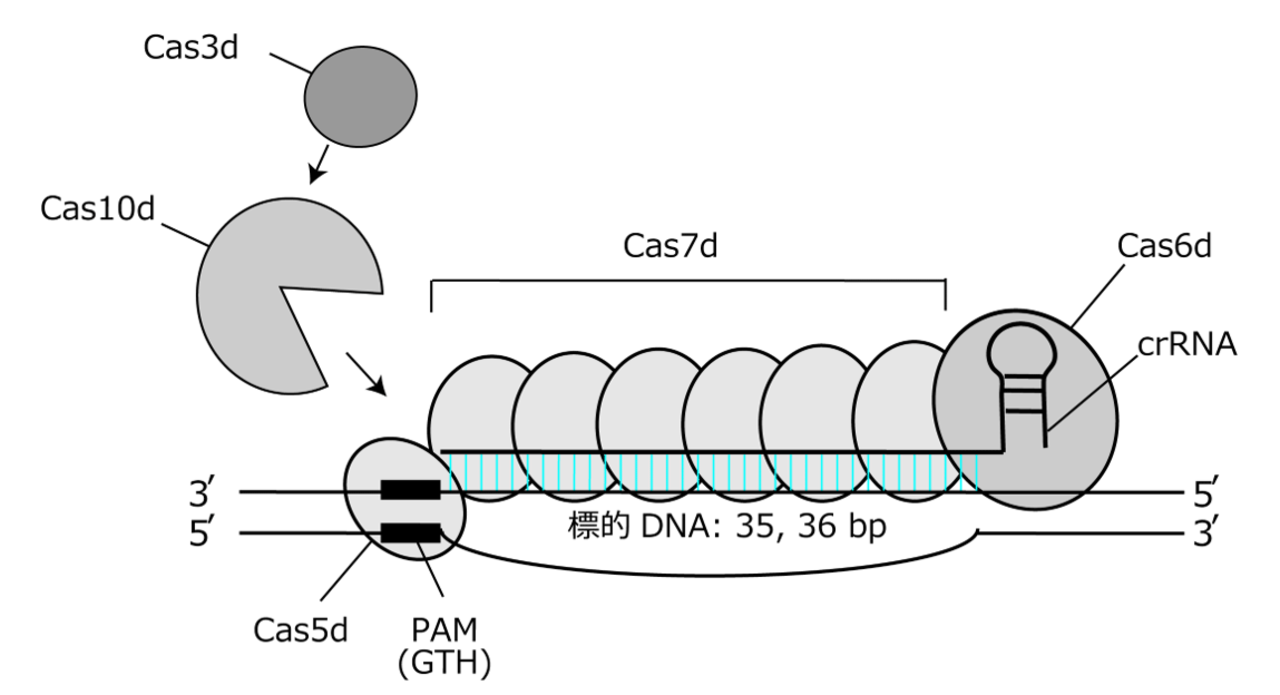
図1. 新規ゲノム編集技術TiDの概要図
本研究により、Cas10dはヌクレーゼ機能を有し、Cas3dの複合体へのリクルートに必要であることが明らかになった。
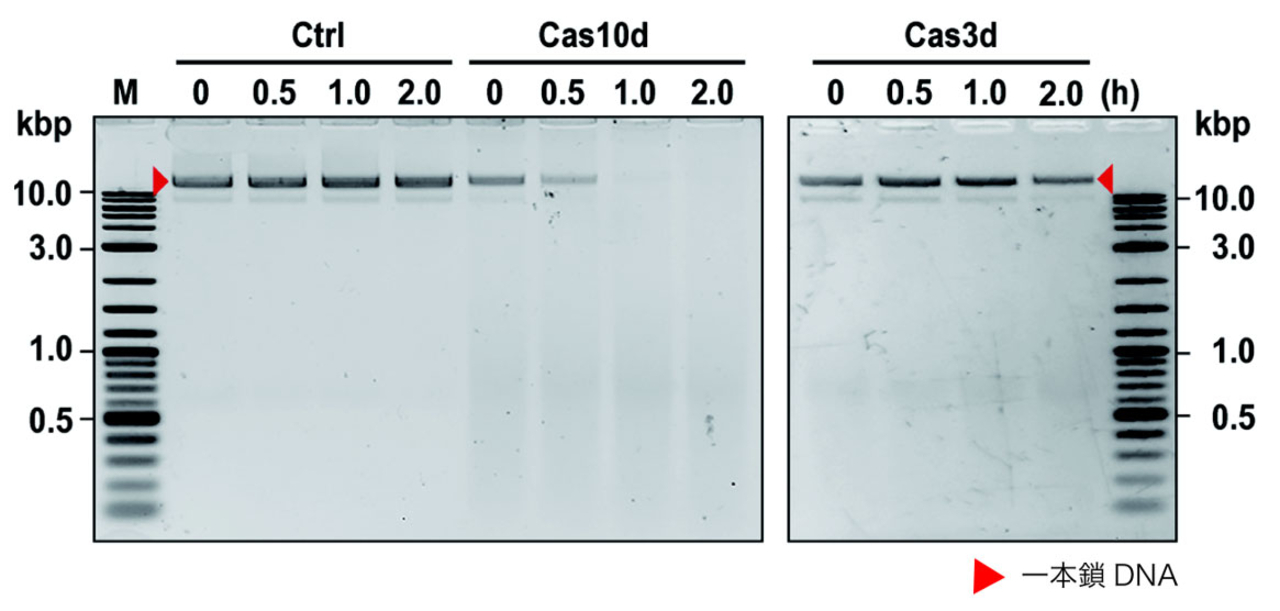
図2. 試験管内での一本鎖DNA切断活性の検証
Type I-Eシステムで報告のあるCas3ではなく、Cas10dが一本鎖DNAを分解することが示された。
さらに、TiDを用いてヒトHEK293T細胞でのゲノム編集に成功しました(図3)。ヒト細胞でのゲノム編集に向けてTiDを構成するCas遺伝子の発現について最適化を行い、ヒト内在遺伝子への変異導入を行いました。その結果、TiDはCRISPR-Cas9と似た数塩基程度の短い挿入/欠失変異を誘導するのに加え、最長18 kbにも及ぶ長鎖欠失も誘導できることがわかりました(図3)。近年、CRISPR-Cas3が同様に長鎖欠失を誘導することが報告されていますが(Morisaka et al., 2019)、CRISPR-Cas3は標的配列の上流に向けて長鎖欠失を誘導するのに対し、TiDは標的配列に対して両方向に長鎖欠失を誘導するなど、異なる性質を持つことがわかりました。これらの結果は、TiDがヒト細胞でのゲノム編集にも利用できるユニークな新規国産ゲノム編集ツールであることを示しており、遺伝子ノックアウト株の効率的な作出や、狙った染色体領域の削除なども可能であると期待できます。また、ゲノム上のオフターゲット候補サイトにおける変異を解析したところ、オフターゲット変異は導入されていないことが明らかになりました。これは、TiDが高い特異性を持つシステムであることを示唆しています。
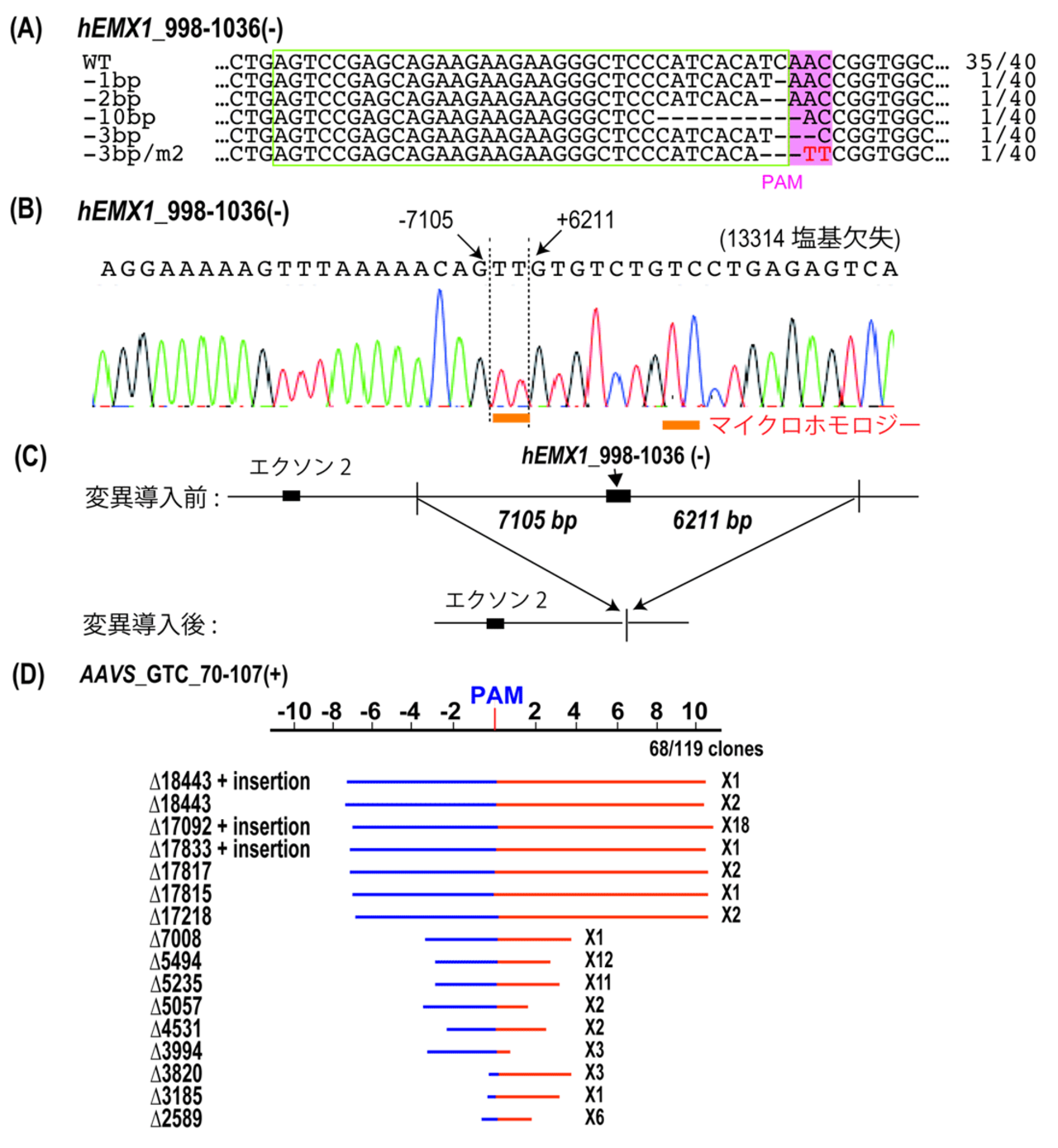
図3. TiDを用いたヒト細胞でのゲノム編集。
A)短い数塩基の欠失変異の検出
B)長鎖欠失変異のDNA配列解析の一例。検出された欠失の両端ではマイクロホモロジーが高頻度で検出された。
C)B)の長鎖欠失変異で起きた遺伝子構造変化の模式図。TiDによりエクソン3を含む13 kbのDNA領域が欠失した。
D)検出された長鎖欠失変異の分布。標的配列を挟んで両方向に2.5 kbから18 kbまでの欠失が検出された。
以上の結果は、TiDが動物細胞でのゲノム編集に応用可能な高い特異性を持つ国産ゲノム編集ツールであることを示しています。今後、得られた知見を元にさらに改良を加えていくことで、ゲノム編集効率の向上や塩基編集をはじめとした様々な技術への利用など、幅広い発展が可能であると考えています。これにより、基礎研究の発展のみならず、医薬、産業、農業分野を含めた様々な分野への応用展開が期待できます。
本研究は、国立研究開発法人新エネルギー・産業技術総合開発機構(NEDO)、産学共創プラットフォーム共同研究推進プログラム(OPERA)、科学技術振興機構研究成果最適展開支援プログラム(A-STEP) 産学共同[本格型]の支援により行われました。
補足説明
CRISPR(Clustered Regularly Interspaced Short Palindromic Repeats) : 真正細菌や古細菌が持つファージなどに対する獲得免疫機構の一つ。標的DNAを認識するRNA分子(crRNAと呼ばれる)およびcrRNAと複合体を形成するCas(CRISPR associated)タンパク質とからなる。現段階では、30種を超える多様なCRISPRシステムが同定されている。
論文情報
掲載誌 : |
Nucleic Acid Research (2021) |
論文タイトル : |
Genome editing in mammalian cells using the CRISPR type I-D nuclease |
著者 : |
Keishi Osakabe*,†, Naoki Wada†, Emi Murakami, Naoyuki Miyashita
and Yuriko Osakabe (†: 共同第一著者) |
DOI : |
お問い合わせ先
徳島大学大学院社会産業学理工学研究部
教授 刑部敬史
E-mail : kosakabe@tokushima-u.ac.jp
Tel : 088-634-6418
東京工業大学 生命理工学院 生命理工学系
教授 刑部祐里子
E-mail : osakabe.y.ab@m.titech.ac.jp
Tel : 045-924-5733
分子動力学シミュレーションによる解析
近畿大学生物理工学部
准教授 宮下尚之
E-mail : miya@waka.kindai.ac.jp
Tel : 0736-77-3888
取材申し込み先
徳島大学 常三島事務部生物資源産業学部事務課総務係
E-mail : bb.gene.section@tokushima-u.ac.jp
Tel : 088-656-8024
東京工業大学 総務部 広報課
E-mail : media@jim.titech.ac.jp
Tel : 03-5734-2975 / Fax : 03-5734-3661
近畿大学生物理工学部 大学運営本部和歌山キャンパス学生センター
E-mail : bost-pr@waka.kindai.ac.jp
Tel : 0736-77-3888