東工大ニュース
東工大ニュース
公開日:2021.07.14
東京工業大学 科学技術創成研究院 細胞制御工学研究センターの加納ふみ准教授、中津大貴助教、國重莉奈特任助教、および東京大学 大学院総合文化研究科の村田昌之教授(研究当時。現:東工大特任教授、東京大学名誉教授)、野口誉之助教(研究当時)、株式会社ニコンの米谷信彦研究員らの研究グループは、新しいタンパク質ネットワーク解析法である「PLOM-CON解析法」を開発し、従来の手法では困難だった細胞内に一過性に生じる2次元のタンパク質凝集体で、生化学的に単離・分析が困難なアクチンドメインの機能解明に成功した。アクチンドメインは糖尿病状態の肝細胞では形成されにくくなる研究結果もあり、この解析法が新しい創薬プラットフォームツールになることを実証した。
従来のタンパク質ネットワーク解析法は、生化学的手法で多数の細胞を集め破壊して得られるタンパク質の平均的な「量」の情報のみに基づいているが、タンパク質の「質・局在」情報の反映なくしては、創薬研究に重要な細胞のシグナル伝達を正しく理解できないことが課題であった。そこで、先端的な創薬・医療研究分野では、ヘテロさを特徴とする細胞集団や組織内の単一細胞が持つそれらの情報を考慮し、疾患や薬効が示す細胞状態をタンパク質のネットワークの変化によって知るための新しい解析技術が求められていた。
今回開発したPLOM-CON解析法では、細胞の蛍光抗体染色画像ビッグデータから得られる単一細胞レベルのタンパク質の量・質・局在情報を基に、タンパク質ごとの特徴量を算出し、それらの時間的相関の強弱を指標にして「共変動ネットワーク」として可視化できる。つまり、細胞へのシグナル入力に応答して得られる共変動ネットワークの変化や違いから、細胞状態の違いや変化を担うタンパク質群情報を知ることができる。
具体的に、ラット肝細胞内において、インスリン刺激によって一過性に形成される直径数μmのアクチンドメインの機能を本解析法を用いて解析した結果、アクチンドメインがグリコーゲン合成やタンパク合成に関わる酵素群の集積とその制御を司る重要な場として機能することを実験的に明らかにした。
この「共変動ネットワーク」によって、肝細胞のみならず、様々な細胞のイメージング画像から得られる細胞の形態情報や、タンパク質を含む多様な生体分子の量や質的変化(多階層オミクスデータ[用語1])とを、相関解析的手法によって統合できると期待される。そのため、今回開発した新しい解析方法は、細胞を利用した基礎生命科学に留まらず、創薬や細胞医薬の新たな支援技術として活用できることの実証を連携企業とともに進めている。
研究成果は「iScience」で2021年7月13日(現地時間)に公開された。
細胞内のタンパク質ネットワーク解析は、正常な細胞と疾患細胞の状態の比較や、創薬・細胞医薬分野において薬効の評価などに欠かせない重要な解析である。この様なタンパク質ネットワーク解析における主要な変数は、タンパク質の「時空間的(局在)情報」と「翻訳後修飾[用語2](リン酸化等の「質」)情報」である。多くのシグナル伝達は、細胞へのシグナル入力を契機に、下流のタンパク質群にそのリン酸化などの大きな質的変化と、それに伴うダイナミックな局在変化を引き起こす。こうしたタンパク質の「質・局在」情報は、「量」情報と共に重要性が認識されていたが、従来のネットワーク解析には反映されていなかった。しかし、ネットワークを構成するタンパク質の量・質・局在変化の時空間ダイナミクスの破綻は、そのままネットワーク全体の乱れにつながり、それがさらに細胞状態の異常につながる。そのため特に創薬・医療研究分野では、タンパク質の質や局在を考慮した新しいタンパク質ネットワーク解析技術が期待されていた。
特に生命科学や精密医療分野では、生化学的手法で多数の細胞を集め、それらを破壊して得られる平均的な定量的情報だけでなく、ヘテロさを特徴とする細胞集団や、組織内の単一細胞が持つ情報の取得とその利用が重要になってきている。具体的には、ヘテロな細胞集団から特定の細胞を選別し、単一細胞レベルでのタンパク質情報を精度良く定量的に得て、その情報を基に細胞内のタンパク質ネットワークを作成する技術が必要とされていた。
実際にこうした細胞内のタンパク質の「量・質・局在」情報を最もよく保持しているのは、細胞の蛍光抗体染色「画像」とされている。本研究で構築したPLOM-CON解析法(Protein Localization and Modification-based Covariation Network analysis method)では、蛍光抗体法[用語3]を利用して、光学顕微鏡下で識別できる単一細胞レベルや直径数μmの細胞小器官(オルガネラ)から、様々なタンパク質の量・質・局在情報をタンパク質ごとの「特徴量」という定量値として取得した。この特徴量の時系列変動の相関の強さを指標にし、「共変動ネットワーク」という新しいタンパク質ネットワークとして表した。この共変動ネットワークは、細胞に入力したシグナルに応答するタンパク質間では、様々な特徴量同士が時間的にも同調した動きをするという仮定のもとに、タンパク質名をノード(円)に、時間的相関の有無をエッジ(線)で表すことで作られる。
本研究ではこのPLOM-CON解析法を、インスリン刺激を受けたラット肝臓由来培養細胞H4IIEC3細胞内に一過性(短寿命でその半減期数分)に形成される、直径数μmの微小なアクチンドメイン(図1、アクチン線維と多数のインスリンシグナルタンパク質が集積する)の機能解析に応用した。シグナルタンパク質の「リン酸化体」(シグナル伝達の短寿命中間体)などの翻訳後修飾体の量や局在は、抗体を用いて検出できる。そのため、アクチンドメインのようにシグナルタンパク質群が一時的に集まり機能するが、生化学的に単離・分析が困難なタンパク質高次構造体の機能解析には、PLOM-CON解析法が適している。
図2は、インスリン刺激を加えた瞬間(0分)から60分の肝臓細胞の共変動ネットワークを示す。この結果から、インスリンシグナル経路の中心的分子であるリン酸化Akt(p-Akt(Ser473))を中心に、グリコーゲン合成に関わるリン酸化GSK3β (p-GSK3β (Ser9))、糖新生に関わるFoxO1、タンパク合成に関わるp70S6K、初期エンドソームマーカーのEEA1などが強い時間的同調性を示していることが明らかになった。また、このようなネットワークから、時間的同調性が互いに強いタンパク質群が作るコミュニティーを抽出するグラフクラスタリング手法を用いることで、このネットワークが、Aktとリン酸化Akt(p-Akt(Ser473))を共通に持つ、2つのコミュニティーで構成されていることも明らかになった。1つは、リン酸化GSK3βを含むグリコーゲン合成に関わるコミュニティー(I)であり、もう1つは、FoxO1を含む糖新生に関わるコミュニティー(II)である。
共変動ネットワークの特徴として、特徴量は細胞の場所情報(核、細胞質、アクチンドメイン(今回の場合))を含んでおり、その情報をノードの周りの色付きの小円(サブノード)として示すことができる。興味深いことに、コミュニティー(I)の分子同士は、今回注目している「アクチンドメインを示すサブノード」(図2 C、黄色)を介して結ばれているものが大多数であることが分かった。つまり、アクチンドメインの生理機能として、インスリン刺激によって肝細胞内で活性化されるグリコーゲン合成の制御場である可能性が高いことになる。
実際に、アクチンドメインの形成を阻害する条件では、インスリン依存的なグリコーゲン合成が阻害され、さらにこのドメインにはグリコーゲン合成に関わる酵素類の一過性の局在も観察されている。このことからアクチンドメインは、肝細胞に入力されたインスリンシグナルを制御するAktやそのリン酸化体を介して、グリコーゲン合成(その他にも、タンパク合成やDNA合成)を制御するタンパク質分子の集積地であり、このシグナル伝達の「ハブ」として機能していることが分かってきた。
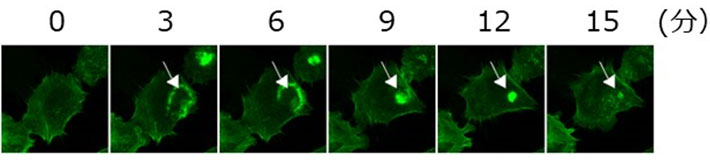
図1. インスリン刺激で一過性に形成されるアクチンドメイン
ラット肝由来培養細胞・H4IIEC3細胞にLifeAct-GFP(アクチン可視化マーカー)を発現させ、インスリン刺激後タイムラプス観察を行った。インスリン刺激によりアクチンが一時的に集合し、ドメイン構造(矢印)を形成する。ここにはリン酸化Aktなどのシグナル伝達分子も集積する。このような細胞内に一過性にできる短寿命の高次タンパク質構造体の生化学的研究は難しいが、PLOM-CON解析法はそれを可能にした。
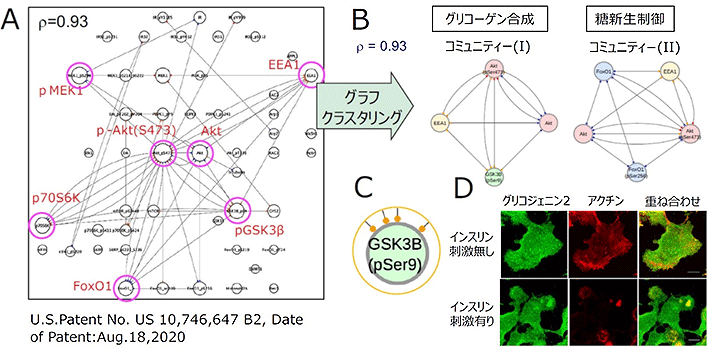
図2. インスリン刺激肝臓細胞での共変動ネットワーク
ラット肝由来培養細胞・H4IIEC3細胞のインスリン刺激(60分)に同調して動くタンパク質群を共変動ネットワークで表した (A)。pAkt(Ser473)から多くの線(エッジ)が張られており、インスリンシグナル伝達を制御する重要な分子であることが分かる。また、グラフクラスタリング法によって、つながりの強い分子群からなるコミュニティーを抽出した(B)。サブノード情報(C、黄色はアクチンドメイン領域を示す)から、アクチンドメインがグリコーゲン合成酵素類を一過性に集積させて機能させる「ハブ」であることが分かった(D)。
PLOM-CON解析法により得られる共変動ネットワークでは、解析対象のタンパク質同士の「時間的同調性」のみを指標にエッジが張られるため、同一細胞内または隣接する細胞内にある、「直接相互作用していないタンパク質間」の共変動をエッジでつないで解析できる。つまり、同一細胞のオルガネラ間や、オルガノイドなどの多種類の細胞の混合培養系に入力したシグナルタンパク質間のネットワークを基に、オルガネラ連関や細胞連関に関わるタンパク質シグナルの動きを検出できる。またこの手法自体が、シングルセルレベルの特徴量の「相関」を基にした解析であるため、昨今の精密医療に欠かせない「シングルセル解析[用語4]」や多階層オミクスデータとの親和性が強い解析手法である。
こうした特徴から、PLOM-CON解析法は、新規薬剤の標的分子や、その主作用や副作用の推定が可能であるため、創薬支援研究に積極的に使われ始めている。具体的に、個体での効果が見いだされていながらターゲット分子が分からない薬剤の標的タンパク質抽出にも既に応用されており、今後、因果推定を得意とするAI創薬技術との融合により創薬プロセスの格段の加速が期待される。
さらに、疾患iPS細胞やiPS細胞から分化させた細胞の超早期の特性解析にも威力を発揮することも分かっており、疾患や薬剤処理した細胞、ウイルスや細菌感染した細胞などの「細胞状態」の初期変化を、この共変動ネットワークを利用して捉えることで、将来的に細胞医薬の発展につながることも期待できる。
共変動ネットワークの多方面への社会実装は、タンパク質の量的変化だけでなく、それらの質や局在変化を指標にした全く新しい創薬戦略を産むだけでなく、新しい機能を持った細胞の「設計」やその「評価」に活用できる新しい「細胞デザイン」の基盤技術としても注目されている。
今後は本技術のさらなる展開に向けて創薬・細胞医薬企業との積極的な協働研究を目指したい。
付記
本研究は下記の支援により行われた。
用語説明
[用語1] 多階層オミクスデータ : トランスクリプトーム(転写産物)、プロテオーム(タンパク質)、メタボローム(代謝産物)などの網羅的データ。
[用語2] 翻訳後修飾 : タンパク質が生合成された後に酵素などにより受ける、リン酸化、アセチル化、ユビキチン化などの総称。本文では「質」情報と表している。
[用語3] 蛍光抗体法 : 抗体の基質特異性を利用して、細胞内の特定のタンパク質を可視化する方法。固定し、膜を可溶化した細胞に、特定タンパク質を特異的に認識する抗体(一次抗体)を加え、その後に一次抗体に結合する蛍光標識抗体(二次抗体)を加える。蛍光顕微鏡や共焦点レーザー顕微鏡により、細胞内の特定タンパク質が可視化できる。
[用語4] シングルセル解析 : 一細胞レベルで、ゲノム、転写産物、タンパク質、代謝産物などの網羅的解析を行う技術。ヘテロ性を持つ細胞や組織をすり潰した平均値ではなく、個々の細胞の発現レベルが解析可能。
論文情報
掲載誌 : |
iScience |
論文タイトル : |
Microscopic image-based covariation network analysis for actin scaffold-modified insulin signaling |
著者 : |
Yoshiyuki Noguchi, Fumi Kano, Nobuhiko Maiya, Chisako Iwamoto, Shoko Yamasaki, Yosuke Otsubo, Daiki Nakatsu, Rina Kunishige, and Masayuki Murata |
DOI : |
お問い合わせ先
東京工業大学 科学技術創成研究院 細胞制御工学研究センター
准教授 加納ふみ
E-mail : kano.f.aa@m.titech.ac.jp
Tel : 045-924-5676 / Fax : 045-924-5682
東京工業大学 科学技術創成研究院 細胞制御工学研究センター
特任教授 村田昌之
E-mail : murata.m.ah@m.titech.ac.jp
Tel / Fax : 045-924-5682
JST事業に関すること
科学技術振興機構 未来創造研究開発推進部
庄司真理子
E-mail : kaikaku_mirai@jst.go.jp
Tel : 03-6272-4004 / Fax : 03-6268-9412
AMEDに関すること
国立研究開発法人日本医療研究開発機構(AMED)
シーズ開発・研究基盤事業部 革新的先端研究開発課
E-mail : kenkyuk-ask@amed.go.jp
Tel : 03-6870-2224 / Fax : 03-6870-2246
取材申し込み先
東京工業大学 総務部 広報課
E-mail : media@jim.titech.ac.jp
Tel : 03-5734-2975 / Fax : 03-5734-3661
科学技術振興機構 広報課
E-mail : jstkoho@jst.go.jp
Tel : 03-5214-8404 / Fax : 03-5214-8432