東工大ニュース
東工大ニュース
公開日:2021.11.29
東京工業大学の柿原慧遵リサーチフェローと福嶋俊明助教、横浜市立大学の森次圭特任准教授を含む研究グループは、難治性疾患クッシング病の発症分子機構の一部を明らかにした。
クッシング病は下垂体のホルモン分泌異常によって起こる。本研究グループはこれまでの研究で、クッシング病患者の下垂体の多くでは脱ユビキチン化酵素USP8に変異が生じており、この変異が疾患発症の原因であることを突き止めていた。今回の研究では、USP8の内部に自己の活性を阻害する領域(自己阻害ドメイン)があり、正常なUSP8ではこの自己阻害ドメインが働いて酵素活性が一定の強さに抑えられていることを発見した。一方、クッシング病患者のUSP8では、変異によって自己阻害ドメインが十分に働かず、USP8が過剰に活性化することを明らかにした。この結果は、USP8の過剰な活性を抑える物質を開発すれば、クッシング病の新たな治療薬になる可能性を示している。
本研究成果は英国の科学誌「Communications Biology」11月8日(現地時間)に掲載された。
クッシング病は、脳の直下に存在する下垂体に腫瘍が生じ、そこから副腎皮質刺激ホルモン(ACTH)[用語1]が過剰に分泌され、それに応じて腎臓のそばにある副腎から糖質コルチコイド[用語2]が過剰に分泌されて起こる疾患である(図1)。患者には満月様顔貌、中心性肥満などの特徴的な外見的変化が起こり、免疫力低下、高血圧、糖尿病などの合併症のリスクも高まる。治療をしないと5年生存率が50%まで低下し、厚生労働省の指定難病の1つとされている。国内推定患者数は約500人で、希少疾患である。治療の第一選択は下垂体腫瘍切除術であるが、高度な医療技術を要するうえ、寛解に至らない、または再発する場合も多い。糖質コルチコイドの合成阻害剤などが治療に利用される場合もあるが、コントロールが難しく、かつ副作用も大きいため、新薬の開発が切望されている。
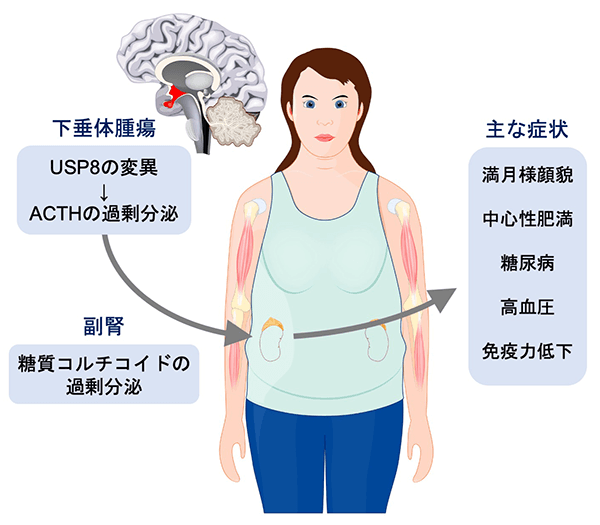
図1. クッシング病の徴候と症状 [designua] © 123RF.com
多細胞動物の体を構成する細胞は、増殖因子と呼ばれる細胞外のタンパク質の指令を受けることにより、増殖が誘導される。増殖因子にはいくつかの種類があるが、細胞膜上にはそれぞれの種類に特異的な受容体が存在している。増殖因子がこうした特異的な受容体に結合することにより、細胞増殖が起こる。また、増殖因子は細胞増殖だけではなく、ホルモンの分泌も誘導するなど多様な働きがある。
今回の研究グループの1人である東京工業大学の駒田教授は長年、そうした増殖因子受容体の輸送を研究してきた。増殖因子の1つである上皮成長因子(EGF)が対応する受容体(EGF受容体)に結合すると、EGF受容体はユビキチンという別のタンパク質によって修飾される。この反応をユビキチン化といい、ユビキチン化されたEGF受容体は細胞膜から細胞の内部へ輸送される。駒田教授はこれまでの研究で、細胞内部のEGF受容体からユビキチンをはずす(脱ユビキチン化する)酵素としてUbiquitin-specific protease 8(USP8)を同定し、脱ユビキチン化されたEGF受容体は細胞内部から細胞膜へリサイクリングされることを明らかにしてきた(図2)。現在では、増殖因子受容体の多くについて、細胞膜上の存在量がユビキチン化と脱ユビキチン化のバランスによって調節されることがわかっている。このようなしくみによって、細胞は適切な感度で増殖因子の刺激を受けとることができ、増殖するか否かが正しく決定されるようになっている。
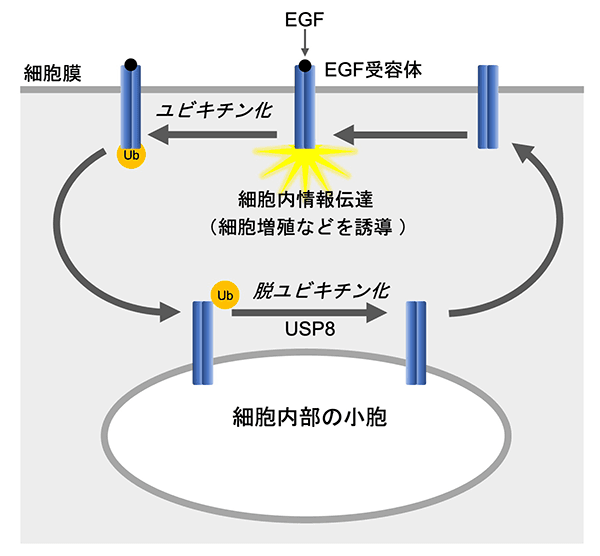
図2. ユビキチン化と脱ユビキチン化による増殖因子受容体の輸送の制御
駒田教授を含む国際研究チームは数年前、クッシング病患者の下垂体腫瘍細胞に含まれる遺伝子の配列を網羅的に調査した。その結果、USP8タンパク質の設計図として働く遺伝子に、非常に高い頻度で異常が起きていることが明らかになった。この発見以降、世界の複数のグループにより調査が進められ、最新の集計では患者の約50%にこの遺伝子の異常がみとめられている。この遺伝子の異常は、USP8の特定部位のアミノ酸配列の欠失や置換を引き起こす。
下垂体細胞は、EGFの指令を受けると盛んにACTHを分泌する。駒田教授らは、クッシング病で見られる異常な配列のUSP8(変異型USP8)を下垂体細胞に発現させると、EGFによって起こるACTHの分泌が強められることを見出した。すなわち、変異型USP8が生じることがクッシング病の原因であることを突き止めたのである。この変異型USP8が発現した細胞では、EGF受容体の細胞膜へのリサイクリングが著しく促進していたことから、変異型USP8ではEGF受容体を脱ユビキチン化する活性が異常に強くなっていると予想されたが、詳細は明らかではなかった。
本研究グループは今回、USP8のアミノ酸配列の異常がこのタンパク質の機能にどのような影響を与え、それによってどのような分子機構を介してクッシング病が発症するかを解明することを目指した。その結果、USP8の内部に自己の酵素活性を阻害する領域(自己阻害ドメイン)を発見した。さらに、生化学実験とタンパク質構造シミュレーションを組み合わせた分析により、正常なUSP8では、EGF受容体などからユビキチンを取りはずす反応に使われるユビキチン結合ポケットを自己阻害ドメインが塞いでおり、酵素活性が一定の強さに抑えられていることを明らかにした(図3左)。一方、クッシング病患者のUSP8では、特定の部位のアミノ酸の欠失や置換が起きているため、自己阻害ドメインがユビキチン結合ポケットを塞ぎにくくなり、USP8が過剰に活性化することを解明した(図3右)。これにより、クッシング病発症の根本的なメカニズムとして、アミノ酸配列の異常によってUSP8が過剰に活性化する詳細な分子機構をはじめて明らかにすることができた。
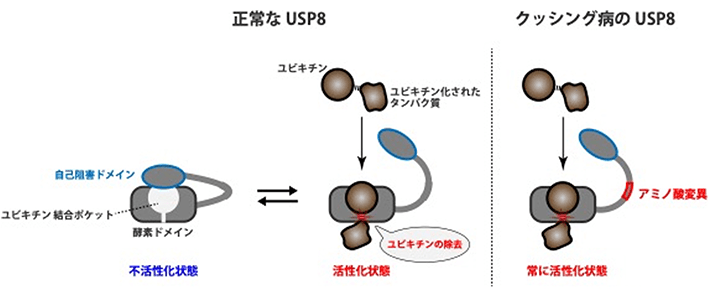
図3. クッシング病で見られるUSP8の機能異常
この成果とこれまでの研究をあわせることにより、次のようなクッシング病の発症メカニズムが明らかになった。(1)アミノ酸配列の異常が起きたUSP8では、自己阻害ドメインがユビキチン結合ポケットをうまく塞ぐことができないため、ユビキチンを認識する能力が高まり、脱ユビキチン化酵素としての活性が過剰となる、(2)過剰に活性化したUSP8はEGF受容体の細胞膜へのリサイクリングを著しく促進し、細胞膜上のEGF受容体の量を増加させる、(3)下垂体細胞にはEGFに反応してACTHを分泌する性質があるので、細胞膜のEGF受容体が多くなることによってACTHの分泌が過剰となり、クッシング病が発症する。
今回の研究では、USP8の過剰な活性化によるクッシング病の発症メカニズムが明らかになった。このメカニズムでは、EGF受容体のほかにも、USP8によって脱ユビキチン化される未知のタンパク質が存在し、クッシング病発症に寄与している可能性も考えられるため、さらに研究を進める必要がある。
今回の研究から、USP8の過剰な活性化を抑制することができれば、約半数のクッシング病患者の症状を根本から改善できる可能性が示された。今後は、USP8にもともと備わっている自己阻害ドメインの構造を詳しく調べることなどによって、USP8を阻害する物質を創出し、新しい作用機序で働くクッシング病の新薬開発に結びつけたい。
用語説明
[用語1] 副腎皮質刺激ホルモン(ACTH) : 下垂体から分泌されるペプチドホルモン。下垂体が副腎皮質刺激ホルモン放出ホルモンやバソプレシン、EGFなどの刺激を受けると、分泌が促進される。副腎皮質に作用し、糖質コルチコイドの分泌を促進する。
[用語2] 糖質コルチコイド : 副腎皮質から分泌されるステロイド骨格構造をもつホルモン。副腎皮質がACTHの刺激を受けると、分泌が促進される。肝臓からの糖新生の促進など代謝を調節する作用や、炎症を抑えるなどの免疫を調節する作用がある。
論文情報
掲載誌 : |
Communications Biology |
論文タイトル : |
Molecular basis of ubiquitin-specific protease 8 autoinhibition by the WW-like domain |
著者 : |
柿原慧遵 浅水謙吾 森次圭 久保正英 北口哲也 遠藤彬則 木寺詔紀 池口満徳 加藤明 駒田雅之 福嶋俊明
|
DOI : |
お問い合わせ先
東京工業大学 科学技術創成研究院 細胞制御工学研究センター
助教 福嶋俊明
E-mail : tofu@bio.titech.ac.jp
Tel : 045-924-5702
取材申し込み先
東京工業大学 総務部 広報課
E-mail : media@jim.titech.ac.jp
Tel : 03-5734-2975 / Fax : 03-5734-3661