東工大ニュース
東工大ニュース
公開日:2022.03.17
東京工業大学 生命理工学院 生命理工学系のチャン・フ・ズイ助教、北尾彰朗教授と大学院生は、東京工業大学のTSUBAME3.0などのスーパーコンピュータでPaCS-MD/MSM法[用語1]などのシミュレーションを行い、新型コロナウイルスが作る酵素タンパク質Nsp15の機能を阻害する候補化合物を発見した。
ウイルスが体内に侵入した際、ウイルスの作るRNA[用語2]を感知することで人体の免疫機能が働くが、Nsp15はコロナウイルスが作ったRNAを分解することで、ウイルスの存在を気付きづらくして、感染を容易にしていると考えられる。本研究ではNsp15がその活性型であるホモ6量体[用語3]を形成する前の単量体[用語4]の立体構造をPaCS-MD/MSM法を用いて推定した。次に約5万個の抗ウイルス化合物の中から単量体に強く結合して6量体化を阻害する可能性のある化合物を複数発見した。これらの化合物は新型コロナウイルスに対する新薬開発に寄与する可能性がある。またウイルスRNAが6量体Nsp15と結合して形成する分子複合体の立体構造も推定した。Nsp15はスパイクやカプシドなどと比べて1~2桁程度変異率が低く、Nsp15阻害剤の効果は変異によって弱まりにくいという性質を持つ。すなわち、Nsp15を阻害する抗ウイルス薬は、さまざまな新型コロナウイルス変異体に効果があると期待できる。
本研究成果は、2022年3月9日付の科学誌「Scientific Reports」に公開された。
ウイルスなどの異物が体内に侵入した際、人体はさまざまな免疫機能を働かせて、異物の排除や防御を試みている。例えば、ウイルスのつくるRNAを感知する機能が人体には備わっているが、新型コロナウイルスの感染においてはRNA感知機能を妨げていると考えられている。その要因とされているのが、新型コロナウイルスが作り出すNsp15という酵素タンパク質の存在である。Nsp15は、新型コロナウイルスが作り出したポリウリジンRNAを鎖の途中で切断するエンドリボヌクレアーゼと呼ばれる酵素で、体がRNAの存在を検知して感染を防御する機構を妨げている。従って、Nsp15の機能を阻害することができれば、免疫機能で新型コロナウイルスの感染をより抑制できると考えられる。また新型コロナウイルスのNsp15はスパイクやカプシドなどのウイルス由来のタンパク質と比べて1~2桁程度変異率が低いため、阻害剤の効果が変異によって弱まりにくいと期待される。すなわち、Nsp15を阻害する抗ウイルス薬は、さまざまな新型コロナウイルス変異体に効果があると期待できる。
また、Nsp15はそれ単体ではなく6つ集まってホモ6量体を形成することで、RNAを分解する機能を発現し、人体の免疫を阻害すると考えられるため、6量体化を防ぐことが重要である。さらに、変異が起こりにくい6量体を構成する単量体間の界面をターゲットとすれば、6量体化を抑制して機能を阻害しつつ、より変異による影響を受けにくい阻害剤を開発できる可能性がある。
本研究グループでは、Nsp15の6量体化を阻害する物質を探索するために、「Nsp15単量体の構造の推定」「阻害標的部位と、阻害機能を持つ化合物の検討」の2つのステップで研究を進めた。
Nsp15の6量体形成を防ぐために、まず単量体の構造と、6量体形成やRNA分解に寄与する部位を見つけることが重要と考えた。Nsp15が形成する6量体の立体構造は既に決定されているが、単量体が単独で存在するときの立体構造は知られていなかったため、コンピュータシミュレーションによって構造推定を試みた。本研究では、北尾研究室で開発した、スーパーコンピュータで高効率・高精度のシミュレーションができるPaCS-MD/MSM法を活用した。PaCS-MD/MSM法の一種であるrmsdPaCS-MD/MSM法を東京工業大学のTSUBAME3.0で実行して、単量体Nsp15が取りうる最も安定な立体構造を見つけ出した(図1)。
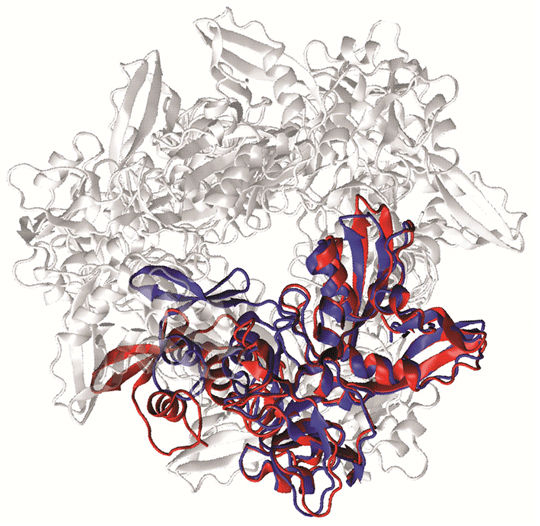
図1. Nsp15の6量体と単量体の立体構造比較
単量体のみで存在しているときのNsp15の構造(赤)を、6量体中での単量体の構造(青)に重ね合わせてみると、構造が異なることが見てとれる。
次に単量体上で化合物が結合するのに適したポケットと呼ばれる部位を探し、さらにポケットに強く結合する可能性がある化合物を、約5万個の抗ウイルス化合物の中からヴァーチャルスクリーニングと呼ばれる計算で複数見出した。ヴァーチャルスクリーニングは結合親和性の予測能があまり高くないので、より高精度で化合物の結合親和性を推定できるdPaCS-MD/MSM法を用いて複数の化合物の結合能を詳しく調べ、Nsp15単量体に強く結合して6量体化を阻害する可能性を持つ化合物を複数発見した(図2)。
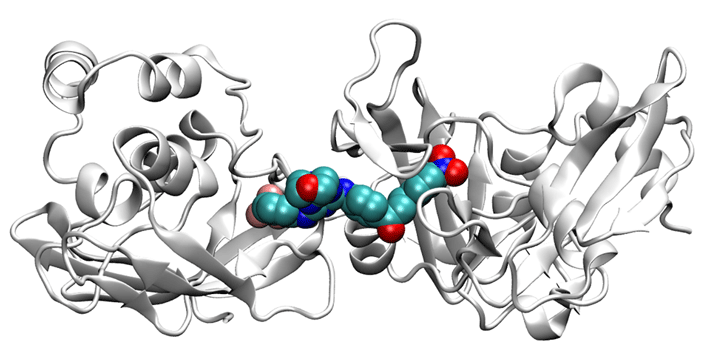
図2. Nsp15単量体に結合した化合物の立体構造
Nsp15(白)に結合した化合物(空間充填モデル)。Nsp15に化合物が入り込み、6量体化を阻害する。
この過程で、Nsp15とRNAが結合する部位について、これまで知られていなかった部位があることが明らかとなった。この新しいRNA結合部位は、6量体上では既知の結合部位の近くにあるが、異なる単量体上に存在している(図3左)。Nsp15は2つの結合部位でRNAを結合することで6量体へのRNAの結合を安定させ、RNAの分解を容易にしていると考えられる。これらの2つのRNA結合部位の情報から、さらにRNA鎖がNsp15と結合した状態の立体構造モデルをシミュレーションで推定した(図3右)。
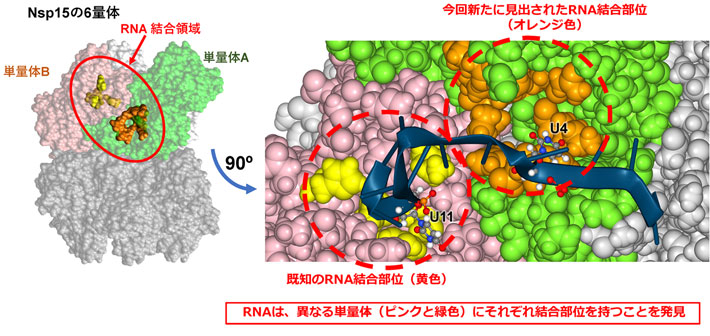
図3. Nsp15の6量体上にある2種類の結合部位(左)とNsp15の6量体と結合したRNA鎖(右)
左:6量体上には結合部位(オレンジ, 新規に発見)は単量体(緑)上にあり、既知結合部位(黄)は別の単量体(ピンク)上にある。右:RNA鎖(濃青)は2つの部位(U4およびU11)でNsp15の6量体と結合すると予想された。
この研究で得られた化合物は、新型コロナウイルスに対する新薬開発に寄与する可能性がある。またNsp15とウイルスRNAが形成する分子複合体の立体構造情報から、Nsp15が酵素として働く仕組みをさらに詳しく調べることが可能になる。
付記
本研究の計算には、HPCI 新型コロナウイルス感染症対応課題臨時公募の支援(課題番号:hp200152)を受け、東京工業大学TSUBAME3.0を主に用いて実施した。
また、本研究は文部科学省「富岳」成果創出加速プログラム「プレシジョンメディスンを加速する創薬ビッグデータ統合システムの推進」(JPMXP1020200201)および「全原子・粗視化分子動力学による細胞内分子動態の解明」(JPMXP1020200101)の一環として行われ、本研究の一部はスーパーコンピュータ「富岳」の計算資源の提供を受け、実施した(課題番号:hp210029、hp210172、hp210177)。
用語説明
[用語1] PaCS-MD/MSM法 : PaCS-MD(並列カスケード選択分子動力学)とMSM(マルコフ状態モデル)を組み合わせた計算法。分子動力学は、タンパク質・核酸・水・イオンなどからなるシステムが時間に沿って変化していく様子を原子レベルのモデルを使ってコンピュータ上でシミュレーションする方法である。PaCS-MDは、多数の独立な分子動力学を並列で短時間実行し、得られた構造の中から観察したい現象に近い構造を複数選択し、それらを出発構造として分子動力学を再実行するサイクルを繰り返すことで、実時間より数桁短いシミュレーション時間で重要な現象を観察できる。MSMは多数の分子動力学で得られた結果を統合して状態の確率や自由エネルギーを計算できる。rmsdPaCS-MD/MSM法は、立体構造変化に伴う自由エネルギー変化を、dPaCS-MD/MSM法は分子複合体の結合親和性(結合自由エネルギー、解離速度定数など)を高精度に予測できる。
[用語2] RNA : リボ核酸のこと。コロナウイルスはDNAでなく、RNAを遺伝情報として持ち、感染して増殖する際に大量のRNAを作り出す。その中にはコロナウイルスが作り出す特徴的なポリウリジンRNAが含まれている。
[用語3] ホモ6量体 : 同じ種類のタンパク質6分子が結合して形成される複合体のこと。
[用語4] 単量体 : 複合体を形成する1分子のこと。
論文情報
掲載誌 : |
Scientific reports |
論文タイトル : |
Inhibition of the hexamerization of SARS-CoV-2 endoribonuclease and modeling of RNA structures bound to the hexamer |
著者 : |
Duy Phuoc Tran, Yuta Taira, Takumi Ogawa, Ryoga Misu, Yoshiki Miyazawa, Akio Kitao |
DOI : |
お問い合わせ先
東京工業大学 生命理工学院 生命理工学系
教授 北尾彰朗
E-mail : akitao@bio.titech.ac.jp
Tel : 03-5734-3373 / Fax : 03-5734-3372
取材申し込み先
東京工業大学 総務部 広報課
E-mail : media@jim.titech.ac.jp
Tel : 03-5734-2975 / Fax : 03-5734-3661