東工大ニュース
東工大ニュース
公開日:2022.08.18
東京工業大学 生命理工学院 生命理工学系の相澤康則准教授、大野知幸大学院生(研究開始当時;現在は株式会社Logomix博士研究員)らの研究チームは、株式会社Logomixや神奈川県立産業技術総合研究所と共同で、生細胞内でヒトゲノムを大規模かつ正確に改変する技術UKiS(Universal Knock-in System)を開発し、これまで調べることができなかったヒトゲノムの非遺伝子領域の機能を明らかにした。
ヒトゲノムの98%以上を占める非遺伝子領域は遺伝子発現に影響していると考えられるが、その機能的役割は不明であり、その解明には長いゲノム領域の改変が必要とされる。ゲノム編集技術CRISPR/Cas9[用語1]は生細胞内で狙ったヒトゲノム領域を改変できるが、この技術単独では改変できるゲノム領域の長さに限界があった。
こうした背景から、本研究では新たなヒトゲノム改変技術UKiSを開発し、CRISPR/Cas9単独では不可能な、10万塩基対[用語2]規模(最大29万塩基対)の遺伝子領域の改変に成功した。このUKiSのメリットとしては、改変対象のゲノム領域に余計な配列が残らず、研究者が希望する配列のみを含むような100%の正確性で改変できることや、2コピーずつ存在する遺伝子の両方を正確に改変できることがある。
さらにこのUKiSを用いて、非遺伝子領域の大部分を占めるイントロン[用語3]配列やトランスポゾン[用語4]由来配列を欠損あるいは改変することで、これらの非遺伝子配列が多くの遺伝子の転写[用語5]発現に影響を及ぼしている可能性を示した。こうしたゲノム解析は、長い配列を両方の染色体[用語6]上で正確に改変できるというUKiSの特徴によって初めて実現した。さらにUKiSをiPS細胞(人工多能性幹細胞)[用語7]に適用可能であることも示した。
今後、UKiSのような大規模でかつ正確なゲノム改変技術によって、機能が判明していないゲノム領域の機能的意味が徐々に解明され、近い将来のヒトゲノムの完全理解に繋がると期待される。また産業的にも、疾患特有の変異を人為的に導入した疾患モデル細胞や、患者体内で患部を特異的に攻撃する治療用細胞の開発が可能となるため、創薬研究開発での利用が特に期待される。
本研究成果は、7月21日付の「Nature Communications」に掲載された。
ヒトゲノム全体の中で、遺伝子が占める領域は2%程度で、残りは非遺伝子領域とされている。かつては意味のない“ジャンク領域”とみなされた非遺伝子領域だが、一部の領域は遺伝子の転写を調節していることが示されている。一方で、広大な非遺伝子領域の解析は困難であり、大部分の非遺伝子領域の役割については十分な検証が行われていない。
非遺伝子領域の大部分を占めるのは、イントロン配列とトランスポゾン由来配列である。イントロン配列とトランスポゾン由来配列はそれぞれ、ヒトゲノム全体の約25%と約50%を占めており、それらの配列と遺伝子の転写の関わりを検証することは、ヒトゲノムの成り立ちと働きを理解する上で必須である。しかしこれら配列の機能的役割については、最初のヒトゲノム配列が明らかになってからすでに20年以上経った今でも、未知の部分が多い。
非遺伝子領域が遺伝子発現に与える影響を検証するためには、ヒトゲノム上の非遺伝子領域に改変を加え、転写に対する改変の影響を調べることが最も直接的な方法である。近年のゲノム編集技術の発展によってヒトゲノムの改変は容易となったものの、そうした技術のみでは、長いゲノム領域の改変は依然として困難であり、長大な非遺伝子領域の解析には不向きだった。また、非遺伝子領域の改変が遺伝子の転写に予期せぬ影響を与える事例も知られており、求められるゲノム改変では100%の正確性が必須だった。さらに、ゲノム改変と遺伝子の転写の関係を検証する上では、父親由来と母親由来の両方の染色体上の非遺伝子領域を改変することが望ましい。しかし、上記要件を満たすゲノム改変技術はこれまで実現していなかった。
このような研究背景の下、当研究グループは、ヒトゲノムの非遺伝子領域の役割を直接調べるためには、10万塩基対規模の長い非遺伝子領域を、両方の染色体上で正確に改変する新しい手法が必要だと考え、今回のUKiSの開発に至った。
ヒトゲノム内の長いゲノム配列への改変は通常、相同組換え[用語8]を介して行う。10万塩基対規模の長いゲノム領域の改変効率は低いため、目的変異が導入された細胞を効率的に取得するために、改変配列とともに薬剤耐性遺伝子[用語9]などの選択マーカーを導入することが一般的である(図1左)。しかし、そうした選択マーカー配列などの余分な配列を除かなければ、それらが遺伝子の転写に及ぼす可能性が残るため、この手法は改変の影響だけを調べる研究には不向きである。
UKiSは、2段階の選択を行うことで、余計な配列を残さずに父母由来の両染色体上の任意のゲノム領域の配列を好きな配列へと改変することを可能にしている。第1段階では、ゲノム改変の対象となる長い領域を、UKiSマーカー配列と置き換える。UKiSマーカー配列は、薬剤耐性遺伝子とGFP(緑色蛍光タンパク質)[用語10]遺伝子という2種類の遺伝子で構成された配列である。この第1段階ではまず、ゲノム編集技術によるDNA切断によって、相同組換えがより強く誘発される。次に、対象配列とUKiSマーカーの入れ替えが起きた細胞が薬剤選択を生き残る。ここで、種類の異なる薬剤耐性遺伝子をもつ2種類のUKiSマーカーを用い、それぞれに対応する2種類の薬剤選択を行うことで、両方の染色体上の対象配列がUKiSマーカーと置き換わった細胞を得ることができる(図1右)。改変の第2段階では、UKiSマーカー配列を研究者が望む改変配列と置き換える。この時、GFP由来の蛍光が消失した細胞を回収すれば、両方の染色体上で改変配列に置き換わった細胞を得ることができる。
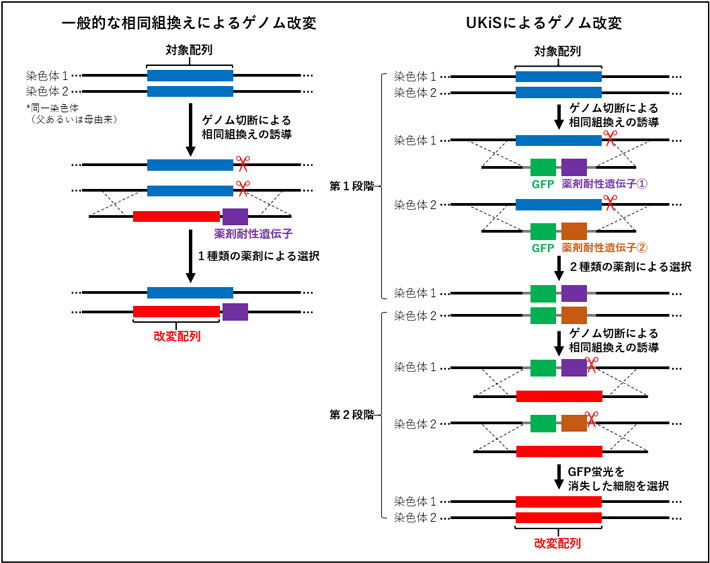
図1. 従来の相同組換えによるゲノム改変法とUKiSの比較
(左)一般的な相同組換えによるゲノム改変法のスキーム。ゲノム編集技術を用いたゲノム切断(図中の赤いはさみ)と薬剤選択により、目的変異の導入された細胞の取得効率を向上させている。
(右)UKiSのスキーム。第1段階で、両染色体上の改変対象配列を2種類のUKiSマーカーのいずれかと置き換えたのち、2種類の薬剤による選択で目的の細胞を取得する。第2段階では、2つの染色体上のUKiSマーカー配列を改変配列と置き換える。
UKiSがヒトゲノムの改変に有用かどうかを検証するため、ヒト結腸がん由来細胞HCT116に対し、がん抑制遺伝子TP53[用語11]の第1イントロン(全長約1.1万塩基対)を欠損させるゲノム改変を試みた。その結果、期待通りイントロンが欠失した細胞を効率よく取得できた(図2(A))。また、作製したイントロン欠失細胞では、TP53遺伝子の転写量が増加していたことから、第1イントロン内に遺伝子の転写を抑制する配列が存在することが示唆された。
さらに、UKiSを用いて同イントロン内部に様々な改変を加え、転写抑制の原因配列を追求した結果、イントロン内に17個存在する霊長類特異的トランスポゾンAlu配列[用語12]が、相加的にTP53遺伝子の転写を抑制していることが明らかになった(図2(B))。従来手法では、複数のAlu配列が遺伝子の転写に与える影響を検証することは困難だったが、長い配列を両方の染色体上で正確に改変できるというUKiSの特徴により、今回の解析が可能となった。
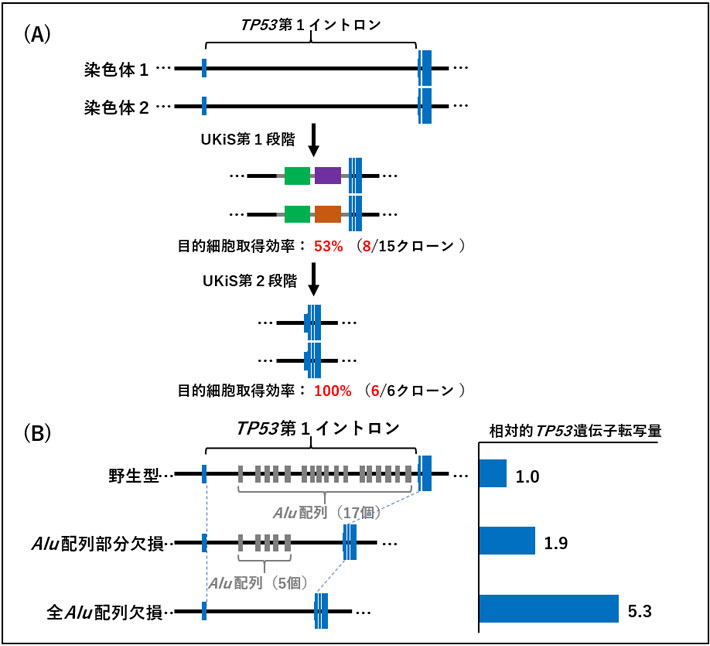
図2. UKiSによるTP53遺伝子第1イントロン改変効率と、TP53転写への影響の検証
(A)UKiSによるTP53第1イントロン欠失改変の模式図。第1段階での2種類の薬剤による選択後に生き残ってきた15クローンを解析した結果、8クローンで、期待通りの改変が導入されていることが確認できた。第2段階では、蛍光選択後に取得した6クローン全てで、期待通りの変異が導入されていることが確認できた。
(B)第1イントロン内の霊長類特異的トランスポゾンAluを欠損させたことによるTP53遺伝子の転写への影響を評価した。改変前の第1イントロン(野生型)には、17個のAlu配列が含まれている。UKiSによって、Alu配列を5個だけ残して残りの12個を欠損させた細胞(Alu配列部分欠損)と、全てのAlu配列を欠損させた細胞(全Alu配列欠損)を作製し、野生型のイントロンをもつ細胞とTP53遺伝子の転写量を比較した。その結果、第1イントロンのAlu配列が減少するほど、TP53遺伝子の転写量が増加したことから、第1イントロン内のAlu配列が相加的にTP53遺伝子の転写を抑制していることが明らかになった。
次にUKiSを用いて、TP53以外のさらに長い遺伝子領域の改変を試みた。HCT116細胞に対して、CD44遺伝子、MET遺伝子、APP遺伝子(それぞれの全長は約9.4万塩基対、約13万塩基対、約29万塩基対)の全イントロン配列をUKiSにより欠損させた。その結果、いずれの遺伝子においても、全イントロンが1塩基対の間違いもなく正確に欠損した細胞株を効率よく取得できた。この結果から、UKiSが10万塩基対規模のゲノム改変にも有用であることが示された。
さらに、作製したイントロン欠失細胞の特性評価を行った結果、CD44遺伝子では転写量がほとんど変わらなかったが、MET遺伝子では転写量が検出限界以下まで減少し、APP遺伝子では転写量が20%程度まで減少していた。この結果から、転写活性化におけるイントロンの必要性がヒト遺伝子によって異なることが実験的に示された。
iPS細胞は、様々な組織や臓器の細胞に分化可能であり、疾患モデル細胞研究や細胞治療[用語13]、再生医療など、産業上の有用性が高い細胞である。ただしiPS細胞でのゲノム改変の効率は低い。今回、ヒトiPS細胞に対するTP53遺伝子第1イントロン欠損をUKiSによって試みたところ、幹細胞性を損なうことなく、イントロン欠損変異を効率よく導入した細胞を取得できた。このことは、UKiSが産業有用性の高いゲノム改変型iPS細胞の開発に活用できることを示している。
基礎研究と産業応用研究の両方において、UKiSの有用性は高い。ヒトゲノムの98%以上を占める非遺伝子領域の役割を理解する上で、父母由来の両染色体上の長いゲノム領域を正確に改変できるUKiS法は強力な技術である。このUKiSを用いて、ヒト細胞内で様々なゲノム領域を精密かつ大胆に改変した上で、その改変の影響を調べることで、ヒトゲノム配列の完全理解に大きく貢献できると期待される。また、このUKiSの特徴を活用すれば、これまで作製が不可能だったヒト細胞を作ることができるため、産業的応用性も高い。特に創薬分野では、特定の疾患にみられる複雑なゲノム変異をUKiSで導入することで、その疾患の特性を模倣する細胞を作ることができる。また、現在創薬分野で世界的に活発に研究が進められている細胞治療の領域でも、UKiSを利用した画期的な治療用ヒト細胞の開発が可能になるだろう。
本研究は、2017年に発足したゲノム構築国際コンソーシアムGenome Project-Write(GP-write)から、「現在のゲノム工学時代に重要なプロジェクト(GP-write Pilot Project)」として認定を受けている7つのプロジェクトの1つである。今日、最先端ゲノム工学をベースとした合成生物学がバイオエコノミーを推し進めるという認識が国際的に広まりつつあり、ヒトゲノムを対象にした工学技術であるUKiSは今後、その有用性が国内外で注目されると期待される。
付記
本研究は、東京工業大学の大野知幸大学院生(研究当時)、赤瀬太地大学院生、河野隼也大学院生(研究当時)、倉澤光大学院生(研究当時)、高島卓斗大学院生(研究当時)、金子真也助教、相澤康則准教授からなる研究チームによって行われた。
用語説明
[用語1] ゲノム編集技術CRISPR/Cas9 : DNA切断酵素Cas9によって、狙ったゲノム領域に二本鎖切断を誘導し、切断修復過程でゲノムに改変を行う技術。切断部位周辺配列の欠損などの変異の導入や、ドナーDNAを介した任意の配列との置換などが可能である。
[用語2] 塩基対 : 2つの塩基が水素結合によって繋がったもの。ゲノム上の遺伝子や非遺伝子領域の長さを表す単位として用いられる。
[用語3] イントロン : 転写はされるが、最終的な転写産物になる過程で除去される塩基配列。一見無駄とも思えるイントロンだが、遺伝子発現の制御との関わりが示唆されている。
[用語4] トランスポゾン : ゲノム上の位置を移動できる塩基配列。カット&ペースト方式で、ゲノム上の別の位置に移動するDNA型と、コピー&ペースト方式で、自己のコピーをゲノム上の別の位置に挿入するRNA型が存在する。
[用語5] 転写 : 遺伝子発現の最初に起こる、遺伝子の情報をもとにしたRNAの合成のこと。
[用語6] 染色体 : ゲノムDNAとタンパク質の巨大な複合体であり、ヒトゲノムは父親由来の23本と、母親由来の23本の染色体に分割されている。性決定に関わる染色体上を除き、1つの遺伝子は、父親由来と母親由来両方の染色体上にあり、合計2コピー存在する。
[用語7] iPS細胞(人工多能性幹細胞) : 皮膚細胞や血球細胞などの体細胞に、初期化因子と呼ばれる遺伝子を導入することによって、あらゆる組織や臓器の細胞への分化能と自己増殖能を獲得した細胞のこと。
[用語8] 相同組換え : 2本鎖切断によるゲノム損傷部位を、相同な配列を鋳型として正確に修復する機構。鋳型配列として外部から導入したドナー配列を用いることで、切断部位の配列を任意の配列に改変することも可能。
[用語9] 薬剤耐性遺伝子 : 薬剤を分解・不活性化する酵素や、薬剤を細胞外に排出するタンパク質などを産生する遺伝子。
[用語10] GFP(緑色蛍光タンパク質) : 青い光を受けて緑色に光るタンパク質。遺伝子発現のマーカーとして、生物学の実験に広く用いられる。
[用語11] がん抑制遺伝子TP53 : がんの発症を抑制するp53タンパク質を発現する遺伝子。がん患者において、最も頻繁に変異が確認される遺伝子の1つである。
[用語12] Alu配列 : 霊長類特異的なRNAトランスポゾンであり、ヒトゲノムの約10%を占める。ヒトゲノム上には約150万個のAlu由来配列が存在するとされるが、その大部分の機能的役割はわかっていない。
[用語13] 細胞治療 : ヒトの細胞を投与することで病気を治療する方法の総称。近年、細胞治療の一種として、がん細胞を認識する改良を加えられた免疫細胞を用いたがん治療法などが注目されている。
論文情報
掲載誌 : |
Nature Communications |
論文タイトル : |
Biallelic and gene-wide genomic substitution for endogenous intron and retroelement mutagenesis in human cells |
著者 : |
Tomoyuki Ohno, Taichi Akase, Shunya Kono, Hikaru Kurasawa, Takuto Takashima, Shinya Kaneko, Yasunori Aizawa |
DOI : |
お問い合わせ先
東京工業大学 生命理工学院 生命理工学系
准教授 相澤康則
Email yaizawa@bio.titech.ac.jp
Tel / Fax 045-924-5787
KISTEC 事業に関すること
神奈川県立産業技術総合研究所
研究開発部 地域イノベーション推進課
Email rep-kenkyu@kistec.jp
Tel 044-819-2031 / Fax 044-819-2026
取材申し込み先
東京工業大学 総務部 広報課
Email media@jim.titech.ac.jp
Tel 03-5734-2975 / Fax 03-5734-3661