東工大ニュース
東工大ニュース
公開日:2022.10.28
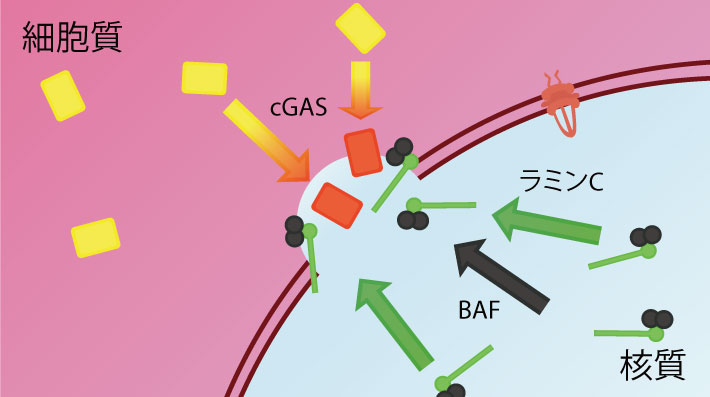
細胞内で破壊された核膜が修復される様子
東京工業大学 科学技術創成研究院 細胞制御工学研究センターの木村宏教授、志見剛特任准教授、河野洋平研究員、ノースウエスタン大学(米国)のRobert Goldman博士とチューリッヒ大学(スイス)のOhad Medalia博士らの国際共同研究グループは、動物細胞の核膜[用語1]に存在する核ラミン[用語2]が持つ、破壊された細胞核膜の修復機構における役割について詳しく解析した。
機械的ストレスなどによって細胞の核膜の一部が破壊されることが知られているが、破壊された核膜の修復機構については不明な点が多かった。本研究では、顕微鏡によるレーザー微小照射を用いて任意の細胞の核膜の一部を破壊し、核膜が破壊された直後に、破壊部位にラミンCのみが迅速に集積していることを明らかにした。また、この集積にはラミンCが核内に豊富に存在していることと、免疫グロブリン様(Ig-fold)ドメインを介したBAF(Barrier-to-Autointegration Factor)[用語3]との結合が必要であることなどの知見を世界に先駆けて見いだした。
この成果は、ラミンの生理的機能の解明だけでなく、ラミン遺伝子の変異を原因とする早老症、心筋症、筋ジストロフィーなどの細胞レベルでの分子病態解明につながると期待される。
本研究成果は第74回日本細胞生物学会大会若手優秀発表賞を受賞しており、2022年10月27日(現地時間)、米国の細胞生物学の専門誌The Journal of Cell Biologyに掲載された。
真核細胞の核では、ゲノムDNAが核膜に包み込まれることによって細胞質から隔離されている。この核膜は細胞分裂の際に崩壊・再構成されることが知られているが、それ以外の場合においても、細胞が押しつぶされたり、引っ張られたりするなどの機械的ストレスによって、核膜の一部が破壊されることが知られている。
ヒトを含む動物細胞では、核ラミナと呼ばれる核膜の内側を裏打ちする構造によって核の形態や機能を維持する役割がある。核ラミナの主要な構造タンパク質であるラミン分子として、A型ラミン(ラミンA、C)とB型ラミン(ラミンB1、B2)が広く発現している。
細胞の核膜が破壊された部位ではラミンB1が欠失し、ラミンAまたはCが局在することは分かっていた。しかし、ラミンAとCのいずれが局在しているのか、さらにこれらのラミンが核膜の修復メカニズムにどのように関与するのかは不明であった。この修復メカニズムは、変異型ラミンによって発症する心筋症、筋ジストロフィー、早老症などの分子病態や、浸潤・転移するがん細胞と核ラミナの機能を理解するために極めて重要であることから、詳細な研究が求められていた。
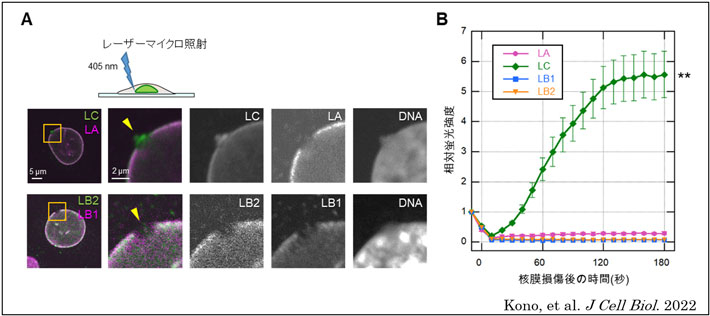
本研究において河野洋平研究員らは、顕微鏡のレーザーを微小領域に照射することで細胞の核膜の一部を任意に破壊できる技術を用いて、核膜が破壊された直後におけるラミンの分子動態を解析した。その結果、下記のようなことを見いだした。
(1)核膜が破壊されてから10分以内では、破壊部位にラミンCのみが集積すること(図1 A)。
(2)ラミンCのみが、核膜が破壊された直後から迅速に集積すること(図1 B)。
(3)核膜が破壊された直後にラミンCが集積するためには、核移行シグナル(NLS)によってラミンCが核質にあらかじめ豊富に存在していること、および免疫グロブリン様(Ig-fold)ドメインを介してラミンCとBAFが結合できることが重要であること。
(4)核膜タンパク質の運び屋であるBAFが破壊部位に集積すること、および損傷したDNAを感知するcGAS(cyclic GMP-AMP Synthase)[用語4]がDNAと結合することに、ラミンAまたはCが関与していること(図2)。
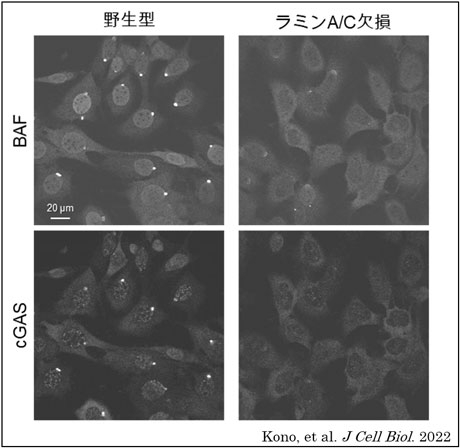
図2. ラミンA/C欠損細胞において核膜が破壊されてから10分後のBAFとcGASの破壊部位への集積が減弱した。
本研究では、硬く線維化した組織のすき間を浸潤するがん細胞などが圧縮されたり、筋肉細胞などが強く伸縮したりすることによって、核膜の一部が破壊されるという現象から着想を得て、その核膜の修復機構へのラミンの関与について詳細に解明した。さらに、ラミンの変異が原因する遺伝子の病気(ラミノパシー)について、免疫グロブリン様(Ig-fold)ドメインが変異するとBAFと結合できないために核膜の初期修復に遅延が生じることが明らかとなったため、変異型ラミンによって発症する心筋症、筋ジストロフィー、早老症などの分子レベルでの病態解明に貢献すると期待される。
細胞周期の間期に起こる機械的ストレスなどによる核膜の破壊について、核膜の修復機構へのラミンの関与が示唆されており、本研究で修復初期にどのラミンが集積するかを特定したことは、細胞生理学的な意義が極めて大きいと考えられる。本研究成果から、破壊された核膜の修復機構、および核膜の恒常性の維持機構の解明につながるだけでなく、今後は早老症、心筋症、筋ジストロフィーに代表される、ラミンの変異を原因とするラミノパシーについて着目し、新規治療戦略の探索などの応用研究へと展開していく。
付記
本研究成果は、科学研究費助成事業(JP20KK0158, JP20K06617, JP18H05527, JP21H04764)により得られたものである。
用語説明
[用語1] 核膜 : 真核生物のDNAを包み込んで細胞質から隔てている膜構造であり、内膜と外膜と呼ばれる2つの脂質二重膜と、それら2層の膜を貫通するように核膜孔複合体が核内外の物質をやり取りする為の核膜孔を構成している。真核生物のうち動物細胞では、核膜内膜の核質側 (ゲノムDNA側) に核ラミナとよばれる裏打ち構造を形成し、核の形態を支持している。
[用語2] 核ラミン : 中間径フィラメントタンパク質の一種で、主にA型ラミン(LA、LC)とB型ラミン(LB1、LB2)がヒトを含む動物細胞で広く発現している。細胞の核膜を裏打ちする核ラミナと呼ばれる厚さ約13.5ナノメートルの網状構造を構成する主要なタンパク質。
[用語3] BAF(Barrier-to-Autointegration Factor) : 二本鎖DNAに結合するタンパク質。細胞分裂期に核膜が再構築される際に、核膜タンパク質の一部をDNAの表層にリクルートする。
[用語4] cGAS(cyclic GMP-AMP Synthase) : 自然免疫を活性化するDNAセンサーとして働く酵素。細胞質内に侵入した外来の二本鎖DNAに結合すると活性化し、cGAMPというシグナル伝達物質を合成することによって、stimulator of interferon gene (STING)を介した炎症反応が誘起される。自己の染色体DNAでは、cGASがDNAではなくヌクレオソームと選択的に結合することで不活化されている。
論文情報
掲載誌 : |
The Journal of Cell Biology |
論文タイトル : |
Nucleoplasmic Lamin C Rapidly Accumulates at Sites of Nuclear Envelope Rupture with BAF and cGAS |
著者 : |
Yohei Kono, Stephen A Adam, Yuko Sato, Karen L Reddy, Yixian Zheng, Ohad Medalia, Robert D Goldman, Hiroshi Kimura, Takeshi Shimi |
DOI : |
お問い合わせ先
東京工業大学 科学技術創成研究院 細胞制御工学研究センター
特任准教授 志見剛
Email shimi.t.aa@m.titech.ac.jp
Tel 045-924-5742
取材申し込み先
東京工業大学 総務部 広報課
Email media@jim.titech.ac.jp
Tel 03-5734-2975 / Fax 03-5734-3661