東工大ニュース
東工大ニュース
公開日:2023.02.03
東京工業大学 生命理工学院 生命理工学系の金森功吏助教と湯浅英哉教授らの研究チームは、DNA[用語1]二重鎖の中間部に光増感剤[用語2]を組み込み、核酸塩基に対して酸化力を持つ活性酸素の発生源たる光増感剤と光酸化[用語3]されるグアニン塩基との間の距離をさまざまに変えながら酸化効率を測定し、両者の距離と光酸化効率の相関を解明した。
CRISPR/Cas9[用語4]などの核酸分解酵素は、遺伝子を切断・破壊して疾病の原因になる特定タンパク質の機能を失わせるノックアウト[用語5]が可能であり、疾病治療法への応用が期待される一方、標的外細胞への攻撃や抗原性[用語6]といった課題がある。
そこで、本研究チームは、抗原性の低いオリゴ核酸を骨格として用い、光照射で標的細胞中の標的核酸を改変できる人工酵素を構築することを最終目標とした。オリゴ核酸鎖の中間部に増感剤を導入し、狙った塩基部位を光酸化することで、遺伝子の転写・翻訳を抑制することによって標的配列の発現を阻害するノックダウン[用語7]の手法を検討している。
その基礎検討として、光増感剤と光酸化を受けるグアニン塩基との間の距離を変えた22種類のDNA-光増感剤複合体を合成し、グアニン塩基の選択的な光酸化が可能か調査を行った。その結果、光酸化における光増感剤とグアニン塩基間の適正距離を解明し、光増感剤から発生する活性酸素のDNA表面上での拡散を追跡することに成功した。この成果は、本研究チームの最終目標である人工核酸改変酵素の実現に向けた第一歩となるとともに、筒状分子であるDNA周囲の粒子拡散を追跡する初の事例となった。
本研究成果は、科学誌「Scientific Reports(サイエンティフィック・レポーツ)」に日本時間1月23日にオンライン掲載された。
CRISPR/Cas9などの核酸分解酵素を用い、遺伝子を破壊して特定タンパク質の機能を喪失させるノックアウトの技術は、特定タンパク質の過剰発現によって発症するがんなどの疾病治療への応用が期待されている。しかし、標的外の健康な細胞への攻撃や、DNAの断片を導入する際にDNAの運び手として用いるウィルスなどが抗原として抗原抗体反応を引き起こすなどの課題が残されていた。
これらの課題を解決する手段として、光による生体分子の機能制御に関する研究を続けてきた本研究チームが検討したのが、「光増感剤を用いて遺伝子上の狙った部位を光酸化することにより、遺伝子の転写・翻訳を阻害して特定タンパク質の機能を抑制する」という光ノックダウンの技術である。
例えば抗原性が低い非タンパク質の低分子化合物を用い、光照射による活性制御によって周囲の標的外細胞への攻撃を防ぎながら、標的細胞中にある狙った核酸の構造を選択的に改変できる人工酵素を構築できれば、上記の課題は克服可能である。そこで本研究チームは、タンパク質に比べ低分子で抗原性が低く標的配列と相補的なオリゴ核酸を用い、その中間部に小さな光増感剤を導入した上で、狙った塩基部位と二重鎖を形成した時点で光照射による酸化を行うことにより、狙った塩基部位を選択的に光ノックダウンできる人工酵素を確立することを最終目標に設定し、その基礎検討を行っていくこととした。
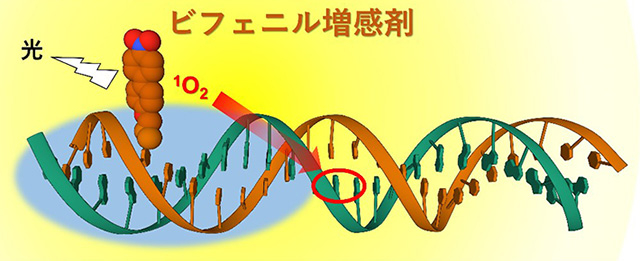
本研究チームは、最終目標となる人工酵素においてオリゴ核酸鎖の中間部に組み込まれる小型増感剤の候補として、すでに世界最小の光増感剤であるビフェニル誘導体(BP)の開発に成功している。このビフェニル誘導体は、光を当てると細胞内の酸素を活性酸素の一種である一重項酸素(1O2)に変換するタイプII型増感剤で、その結果DNA上のグアニン塩基(G)が選択的に酸化され、主にオキソグアニン(OG)が生成される。こうしてグアニン塩基がオキソグアニンに置き換わった核酸では、転写エラーや翻訳の失速が起こり、ノックダウンが誘起される。
このビフェニル誘導体を用いた光増感剤は、大きさが1 nm×0.5 nm、分子量が229と従来の光増感剤と比べても非常に小さく、オリゴ核酸鎖の中程に結合させても、相補鎖との二重鎖形成の邪魔をせず、選択的にグアニン塩基の光酸化が行えると考えられた。そこで本研究においては、人工酵素開発の前段階となる基礎検討として、DNA-ビフェニル増感剤複合体を合成し、グアニン塩基の選択的な光酸化が可能か、および、活性酸素の発生源であるビフェニル増感剤と酸化を受けるグアニン塩基の間の最適な距離はどのくらいかについて検証を行うことにした。
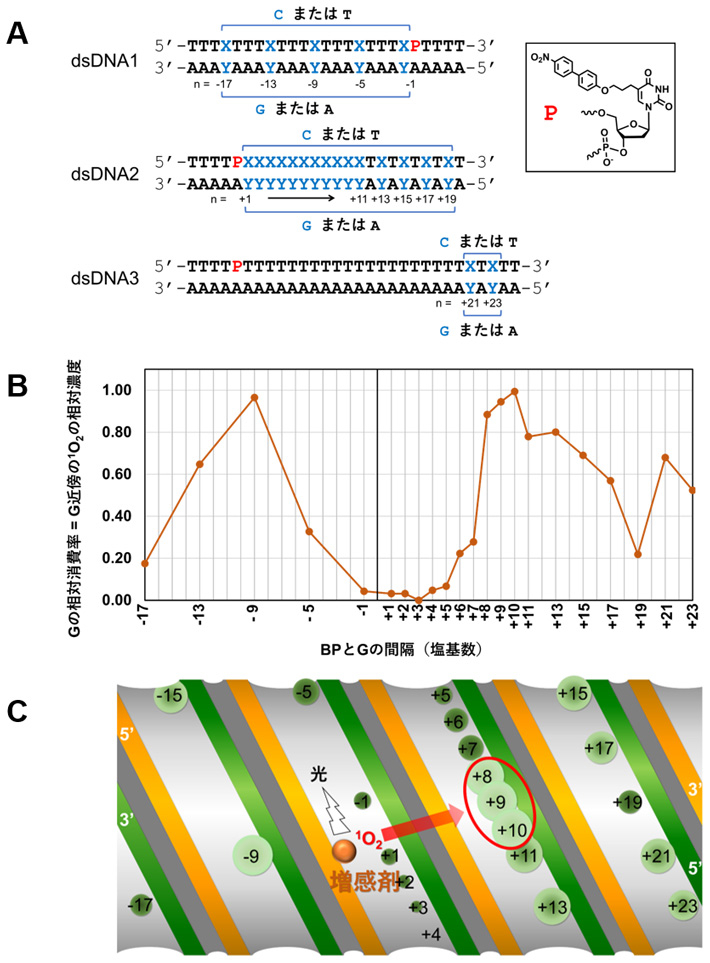
本研究では、上記の人工酵素を構築するための前段階となる基礎検討を行うために、活性酸素の発生源であるビフェニル増感剤と酸化を受けるグアニン塩基の間隔をそれぞれ変えた22種類のDNA-ビフェニル増感剤複合体(図2A、dsDNA1~3)を合成し、各複合体における光酸化効率を検証した。
測定の手法としては、光酸化反応生成物を酵素で分解した後に、モノヌクレオシドとしてのグアニン塩基の残量を測定することにより、グアニン塩基の各位置近傍における活性酸素としての一重項酸素の相対濃度を見積もるという手法で測定を行った(図2B)。
図2Cでそれぞれの円内に書かれた数字は、酸化させるグアニン塩基が光増感剤であるビフェニルの位置から何塩基分離れているかを表しており、円の大きさと色の薄さで酸化効率を表している。この結果、ビフェニルから8個~10個離れているグアニン塩基が一番酸化されやすいことが判明した。すなわち、上記の人工酵素の構築にあたっては、標的とするグアニン塩基から8個~10個離れた位置にビフェニルを配置するようオリゴ核酸を設計すれば良いことになる。
本研究ではさらに、一重項酸素が水分子との衝突で不活性化する影響を調べるため、水より不活性化が少ない重水中での光酸化、ビフェニルが実際に一重項酸素を発生しているかを確認するため、グアニンよりも一重項酸素により酸化されやすいフルフリルアルコールによる一重項酸素のトラップ実験[用語8]、および発生している活性酸素が一重項酸素のみであるか確認するため、一重項酸素阻害実験を行っている。その結果より、ビフェニルから近い位置でグアニン塩基が酸化されにくい理由は、ビフェニルとグアニン塩基の衝突による消光が原因であることが判明し、ビフェニルから5個以上離れたグアニン塩基の酸化効率は、活性酸素の筒状DNA周り拡散の足跡を表すことも見出された。これは、筒状分子周囲の粒子拡散を追跡する初の事例となった。
本研究成果により、任意の配列に対して選択的に、核酸塩基部の光酸化を行えることが明らかになった。本研究はDNAを標的にしているが、RNAを標的にすれば、新たな光ノックダウン法の開発が可能である。光ノックダウン法を用いれば、時間と部位を限定しながら疾病関連タンパク質などの発現を抑制できるため、副作用の少ない疾病治療に応用することが可能である。このような手法が可能になってきたのは、2018年に本研究チームで独自に開発した世界最小のタイプII増感剤(ビフェニル増感剤)があってのことであると言える。
現在、RNAの光ノックダウン法としての医学応用を目指し、東邦大学医学部との共同研究を始めている。また、DNAの光ノックダウン法として、本研究の基礎を土台に、標的DNA二重鎖にビフェニル増感剤を挿入できる技術の構築を目指して検討を行っている。
付記
本研究は、日本学術振興会 科学研究費助成事業 基盤研究B(JP16H04176)、日本医療研究開発機構 先端的バイオ創薬等基盤技術開発事業(JP21am0401028)および橋渡し研究プログラム(JP22ym0126813)の支援を受けて実施された。
用語説明
[用語1] DNA(DeoxyriboNucleic Acid/デオキシリボ核酸) : 塩基と糖とリン酸からなる高分子物質である核酸の一種。遺伝子の本体として、生物の遺伝現象とタンパク質の生成に関わる。二重らせん構造をした長い紐状の形態を取り、アデニン、グアニン、チミン、シトシンの4種の塩基を含み、その配列によってタンパク質のアミノ酸配列が決定される。
[用語2] 光増感剤 : 増感剤は物理的変化の促進剤で、光増感剤はそのうち光を受けて働くものを言う。光を受けて高エネルギー状態となり、そのエネルギーを伝達することでほかの物質の反応を促す。その際、光増感剤自体は変化しない。写真の増感剤や、植物内などに存在して光合成を促すクロロフィルも光増感剤の一種。
[用語3] 光酸化 : 光のエネルギーを受けて発生する光化学反応の一種で、光の吸収によって物質が酸化する現象。
[用語4] CRISPR/Cas9 : 2020年ノーベル化学賞の対象となった人工の核酸分解酵素。ゲノム編集の中核技術で、DNA上にある特定の塩基配列を選択して結合するCRISPRとDNAを切断するCas9からなる。核酸分解酵素の中でも、核酸の分子をヌクレオチド鎖の途中で切断するエンドヌクレアーゼ。
[用語5] ノックアウト : 遺伝子を切断し、修復エラーを誘導してその機能を不活性化することにより、疾病の発生原因などになる特定タンパク質の機能を失わせる遺伝子工学の技法。
[用語6] 抗原性 : 生体内抗原性、免疫原性とも言う。生体に侵入した際、抗体の産生をもたらし、それと結合してアレルギー反応、アナフィラキシー反応、免疫反応などをはじめとする抗原抗体反応を引き起こす。
[用語7] ノックダウン : 特定の遺伝子の転写量を減少させたり、翻訳を阻害することによって、当該遺伝子の発現を抑制する技法。
[用語8] トラップ実験 : 不安定で短寿命の化学種を安定で同定容易な化合物へと変換することにより、その化学種が存在することを証明する実験。
論文情報
掲載誌 : |
Scientific Reports |
論文タイトル : |
Mapping the diffusion pattern of 1O2 along DNA duplex by guanine photooxidation with an appended biphenyl photosensitizer |
著者 : |
Takashi Kanamori, Shota Kaneko, Koji Hamamoto and Hideya Yuasa |
DOI : |
お問い合わせ先
東京工業大学 生命理工学院 生命理工学系
教授 湯浅英哉
Email hyuasa@bio.titech.ac.jp
Tel 045-924-5850
取材申し込み先
東京工業大学 総務部 広報課
Email media@jim.titech.ac.jp
Tel 03-5734-2975 / Fax 03-5734-3661