東工大ニュース
東工大ニュース
公開日:2023.07.11
東京工業大学 生命理工学院 生命理工学系の加藤尭彬大学院生(研究当時)、村上聡教授、岡田有意助教の研究チームは、バークホルデリア菌の多剤排出ポンプの結晶構造解析に成功した。
病原菌に対して抗生物質がほとんど効かなくなる多剤耐性化は、今や大きな社会問題となっている。とりわけ致死性の高い病原菌の多剤耐性化は公衆衛生上の脅威である。その1つであるバークホルデリア菌は、バイオセーフティレベル3の極めて病原性が高い菌で、バイオテロのリスク菌とされる。抗生物質が効きにくいバークホルデリア菌も世界中で多く見つかっている。
研究チームは、バークホルデリア菌の多剤耐性化に関わる2つのタンパク質の立体構造を原子レベルで明らかにすることで、この菌が抗生物質を菌体細胞から排出して効かなくしてしまう仕組みを解明した。具体的には、バークホルデリア菌のポンプタンパク質をコードする遺伝子を大腸菌に組込み、多剤排出ポンプを発現させたうえで、その詳細な構造をX線結晶構造解析法を使って調べた。
今回の研究で、バークホルデリア菌が抗生物質を排出することで効きにくくする仕組みをくわしく理解できたので、今後は排出されにくい抗生物質の開発や、排出ポンプによる排出を抑える物質の開発などへの応用が期待できる。
本研究成果は、東京工業大学 生命理工学院の研究チームと、大阪大学 蛋白質研究所の山下栄樹准教授、米国・ロスアラモス国立研究所のトーマス・ターウィリガー(Thomas Terwilliger)教授、リーウェイ・フアン(Li-Wei Huang)チームリーダー、米国・北アリゾナ大学のハーバート・シュヴァイツァー(Herbert Schweizer)教授らの共同チームによるものであり、7月10日付(現地時間)の「米国科学アカデミー紀要・Proceedings of the National Academy of Sciences of the United States of America」に掲載された。
細菌の薬剤耐性(AMR[用語1])の問題は深刻化し、ほとんど全ての抗生物質が効かなくなる多剤耐性化が大きな社会問題となっている。抗生物質が効かなくなる仕組みのひとつとして、薬剤排出ポンプによる薬剤の菌体外への排出があげられる(図1)。この仕組みは特殊で、一種類のポンプが多種多様な抗生物質を排出でき、これが多剤耐性の原因となるところである[参考リンク1]。村上教授の研究室ではこの多剤排出ポンプの研究に20年以上取り組んできた。
細菌はその病原性重篤さなどを指標に、害の少ないバイオセーフティレベル1(BSL1)から、一般的には病原性の高いレベル3までに区分されている※。レベル3には炭疽菌や、バークホルデリア菌[用語2]が含まれ、共にバイオテロのリスク菌として懸念されている。多剤耐性化したこれらの病原菌の蔓延は公衆衛生上の脅威となりうる。
バークホルデリア菌の主たる多剤排出ポンプであるBpeBとBpeFは、細胞膜上表面に存在する膜タンパク質であり、ポンプのような役割をする。細胞のエネルギーを使ってポンプ蛋白質の分子内部に開いた輸送経路(図2)を消化管の蠕動運動のように構造変化させることで、菌体内で薬効を発揮するはずの抗生物質の分子を細胞の内側から外側へ輸送して排除し、結果として薬剤耐性化を引き起こす。
こうした多剤排出ポンプによる抗生物質の排出の仕組みを本質的に理解することで、ポンプの働きを抑える新薬や、排出されにくい抗生物質の開発などへの応用が期待されている。今回の研究ではこの構造変化の詳細のほか、輸送経路のなかにある抗生物質の認識に関わるアミノ酸残基の種類がわかった。
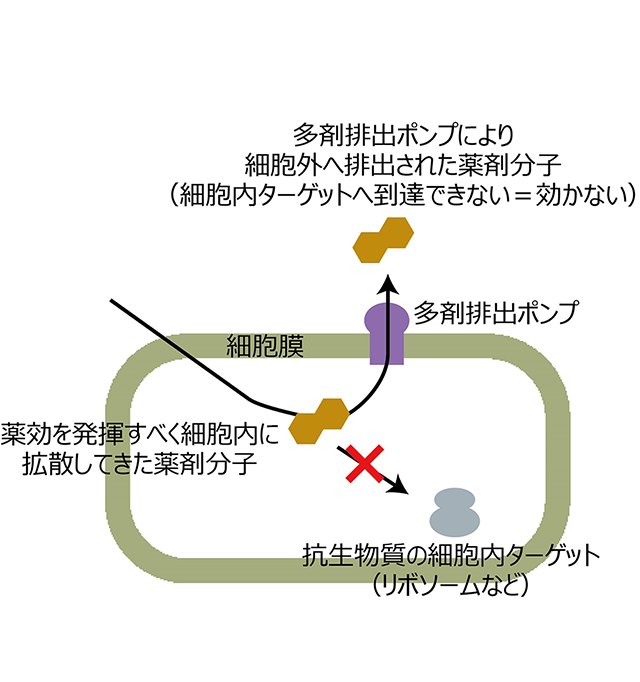
図1. 多剤排出ポンプによる薬剤耐性(AMR)のしくみ
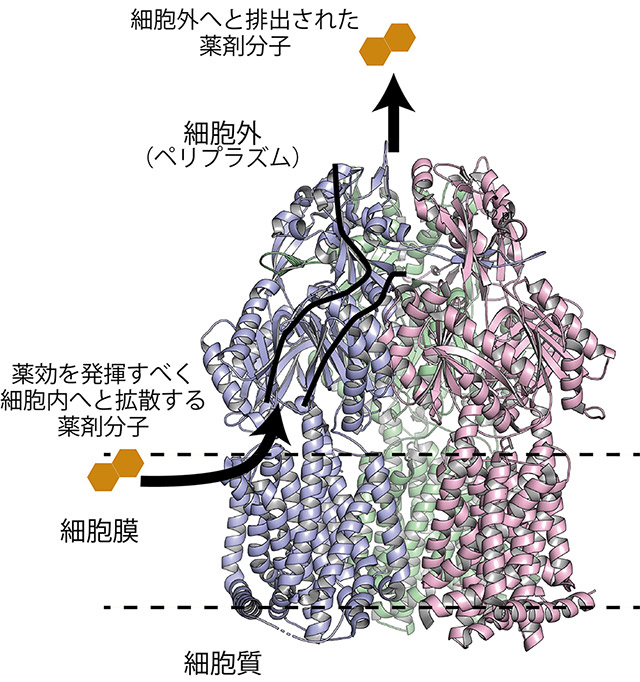
図2. バークホルデリア菌由来 多剤排出ポンプBpeBの立体構造
病原体等安全管理規程(国立感染症研究所)によると、BSL4まで設定があるが、現在レベル4に指定されている細菌はなく、知られている細菌のなかではBSL3が最高である。
バークホルデリア菌はBSL3であるため、一般的な研究施設では取り扱うことができない。そのため研究グループは、バークホルデリア菌のポンプタンパク質BpeBとBpeFをコードする遺伝子を化学的に合成し、大腸菌に組み込むことで、BpeBとBpeFを発現させた。そのうえで、これら2種の多剤排出ポンプをそれぞれ純化し、結晶化させた。これらの多剤排出ポンプの立体構造を、生体分子の立体構造を原子レベルの解像度で解析する手法では最もよく使われるX線結晶構造解析法によって、約3Å(Åは10-10 m)解像度で詳細に解き明かすことに成功した(図2)。
さらに構造情報に基づいて、タンパク質の働きの上で重要と思われる仕組みを担う部分に存在するアミノ酸を、部位特異的変異導入により変異させ、変異体の薬剤耐性能を測定した。これによって、ポンプタンパク質の構造に基づいた働きの仕組みを詳細に調べ、このポンプにより抗生物質が排出される機構を明らかにした。
厚生労働省によると、薬剤耐性菌が世界的に増加する一方で、新たな抗生物質の開発は減少傾向にある。この点は国際社会でも大きな問題として警鐘が鳴らされている。救世主的な新規抗生物質などがこのまま発明されなければ、2050年には再びペニシリン発見の前の時代、つまり有効な抗生物質が無かった時代に逆戻りし、細菌感染症が人類の死因のトップになるという予想さえある。
2015年5月のWHO世界保健総会では、薬剤耐性に関するグローバル・アクションプランが採択された。これを受けて、我が国でも薬剤耐性対策に関する包括的な取組について議論されている。現時点では新たな耐性菌を「生ませない」「拡げない」ことを主たる目標として、抗生物質の適切な使用を徹底するための国民運動を展開することなどのアクションプランに基づき対策が推進されている。
しかしこれが受け身な取り組みであるのに対して、研究グループは、薬剤耐性化の本質的理解という基礎研究を通してこの問題の克服を目指す、攻めの取り組みを行っている。多剤排出ポンプが抗生物質を排出し無効化する仕組みを明らかにし、その現場を原子レベルで観察することで、多剤耐性化の防御策のシーズも浮かび上がってくると考えている。
コロナ明けの今も、感染症におびえた日々の暗さは人々の記憶に鮮明に残っている。そうした観点からも、AMR対策が社会に与える影響は大きく、その必要性はもはや問うまでもないだろう。
インフルエンザやエイズの治療薬開発では、原因タンパク質の立体構造を利用する合理的な薬剤設計(構造ベース創薬[用語3])の手法が用いられたことで、従来法に比べて開発が迅速に進み、費用も抑えられた。こうした経緯から、現在の薬剤開発では疾病の原因タンパク質の立体構造情報が不可欠になっている。今回の研究で、バークホルデリア菌の多剤排出ポンプの構造が明らかになったことで、上記の例と同様に、阻害剤の開発など、病原性細菌全般の多剤耐性化克服へ向けた応用研究の進展が期待できる。
付記
JSPS科学研究費助成事業・基盤研究(B)21H02412による。 また、創薬等先端技術支援基盤プラットフォーム(BINDS)、阪大共同利用の支援により大型放射光施設(SPring-8)のBL-44XU(大阪大学・蛋白質研究所ビームライン)にてX線回折実験を行った。
参考リンク
[1] 【東工大Web体験講義】薬剤耐性化の仕組みを観る|YouTube
用語説明
[用語1] AMR : Antimicrobial Resistanceの略。薬剤耐性と訳される。薬剤耐性のうち、多種多様な薬剤に対して軒並み耐性化したものを多剤耐性と呼ぶ。
[用語2] バークホルデリア菌 : Burkholderia pseudomalleiは類鼻疽の原因菌で、人獣共通感染菌である。バイオセーフティレベル(BSL)3という極めて病原性が高い区分に分類されている。ワクチンは確立しておらず、発症時の致死性が高い。米国CDCによって、バイオテロにおいて生物兵器となりうる対象細菌14種のひとつにあげられている。
[用語3] 構造ベース創薬 : 疾病の原因タンパク質分子に結合する化合物を合理的に設計する新薬開発方法。鍵と鍵穴に例えられるような、タンパク質による薬剤などの低分子化合物の認識に関する構造情報に基づいている。タミフルやリレンザのほか、エイズの治療薬もこの方法により開発された。
論文情報
掲載誌 : |
Proceedings of the National Academy of Sciences of the United States of America |
論文タイトル : |
Crystal structures of multidrug efflux transporters from Burkholderia pseudomallei suggest details of transport mechanis |
著者 : |
Takaaki Kato1, Ui Okada1, Li-Wei Hung2, Eiki Yamashita3, Heung-Bok Kim2, Chang-Yub Kim2, Thomas C. Terwilliger2, Herbert P. Schweizer4, Satoshi Murakami1 1東京工業大学 生命理工学院、2米国・ロスアラモス国立研究所、3大阪大学 蛋白質研究所、4米国・北アリゾナ大学 |
DOI : |
お問い合わせ先
東京工業大学 生命理工学院 生命理工学系
教授 村上聡
Email murakami@bio.titech.ac.jp
Tel 045-924-5748 / Fax 045-924-5709
取材申し込み先
東京工業大学 総務部 広報課
Email media@jim.titech.ac.jp
Tel 03-5734-2975 / Fax 03-5734-3661