東工大ニュース
東工大ニュース
公開日:2023.12.21
東京工業大学 生命理工学院 生命理工学系の峯岸美紗博士後期課程学生(研究当時、現 理化学研究所 開拓研究本部 学振特別研究員PD)、近藤科江特定教授は、自治医科大学 分子病態治療研究センターの口丸高弘准教授、武田憲彦教授、西村智教授らの研究チームと、理化学研究所 開拓研究本部の新宅博文理研白眉研究チームリーダーらと共に、疾患の原因となりえる細胞同士の相互作用を媒介するタンパク質を、数千の候補分子の中から同定する新たな解析手法を開発しました。この解析手法は、sGRAPHICと名付けられた細胞外での再構成GFP[用語1]によって、ある特定の細胞の近くに位置する細胞を光で標識する技術と1細胞オミクス解析[用語2]を組み合わせたもので、細胞間相互作用が関与する疾患メカニズムの解析に幅広く応用が可能です。研究チームは、この技術をがんの転移過程を再現したマウスモデルに利用し、galectin-3[用語3]と呼ばれるタンパク質が、がん細胞と肝実質細胞の相互作用を媒介し、肝転移の形成を促す可能性を見出すことに成功しました。
本研究内容は、英国の学術雑誌であるNature Communicationsに12月5日にオンライン掲載されました。
我々の身体組織は、多種多様な30兆個を超える細胞によって構成されています。それらの細胞は細胞膜表面上に提示されたタンパク質や、細胞外に分泌される液性因子を介して相互作用することで、組織恒常性を維持しています。正常組織における細胞間相互作用が破綻すると、疾患の発症やその悪性化が進みます。特に、がん細胞のような異常な細胞は、周囲の正常細胞との相互作用を巧みに利用して、がん細胞が増殖しやすい特殊な環境(ニッチ)を形成することが示唆されてきました。このようなニッチ形成に基づく疾患メカニズムは、がんの転移過程において特に重要になると考えられています。そのためニッチにて細胞間相互作用を媒介するタンパク質の機能を阻害できれば、新たな治療法の開発につながることが期待できます。一方で、細胞間相互作用を媒介する候補タンパク質分子は数千種類にも及び、その中から重要な相互作用因子を同定することは非常に困難です。この課題を克服するために、細胞間相互作用に関わる細胞集団の1細胞オミクス解析に基づいた相互作用に関わる因子を同定するための包括的な解析技術の確立が進められています。しかしながら、生体深部組織の細胞間相互作用のオミクス解析において、細胞の空間位置情報の精度や十分な分子情報量を両立する技術は未発展でした。
そこで本研究チームは、生体深部組織における細胞間相互作用のオミクス解析を実施するために、標的となる細胞に近接して相互作用する細胞を光標識するアプローチを採用しました。例えば、生体組織においてがん細胞のすぐ近くにいる細胞にその場で“光の目印”をつけることができれば、その目印をもとに破砕組織から相互作用パートナーを探し出すことができます。そして、探し出した細胞の1細胞オミクス解析することで、1つ1つの細胞の詳細な性状解析を通して、細胞間相互作用因子を見出すことが可能です(図1)。
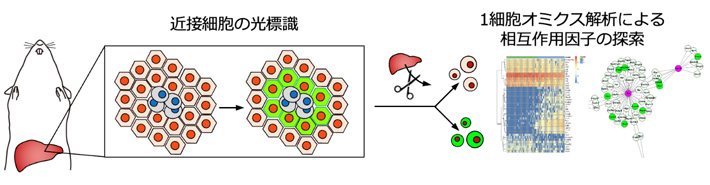
図1. 近接細胞の光標識技術と1細胞オミクスに基づく細胞間相互作用因子の探索
生体組織において特定の細胞に近接し、相互作用する細胞を光標識する。そして、光標識を目印にして、破砕した臓器から細胞間相互作用に関連した細胞を回収し、1細胞オミクスによって相互作用因子を探索する。
これを実現するために、接触した細胞同士を蛍光標識するGRAPHIC[用語4]と名付けられた技術に注目しました。最初に、GRAPHICを用いてがん細胞が関連する細胞間相互作用の検出が可能か検討を進めましたが、十分に蛍光標識できないことが明らかになりました。その理由として、GRAPHICが過去に適用された神経細胞や上皮細胞と異なり、がん細胞は近接する細胞と密着した相互作用状態を取り難く、細胞膜上に提示された分割GFP断片が会合しにくいことが考えられました。そこで、一方の分割断片を細胞外に分泌する新規のシステムを構築し、分泌型GRAPHIC(sGRAPHIC[用語5])と名付けました。培養細胞を使った実験から、sGRAPHICは、GFP断片を分泌する細胞に比較的近位に位置する細胞だけを蛍光標識できることが明らかになりました(図2)。
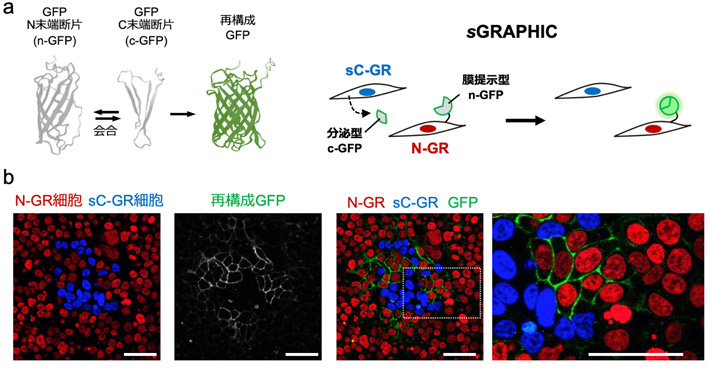
図2. sGRAPHICシステムの概略
(a)分泌されたc-GFPが近傍の細胞膜上に発現したn-GFPと会合することで、再構成GFPの蛍光シグナルが検出される。n-GFPとc-GFPの分子構造はAlphaFold2の予測に基づく。(b)sGRAPHICレポーターを遺伝子導入した細胞を共培養し顕微鏡観察すると、sC-GR発現細胞(青色シグナル)の近くに位置するN-GR発現細胞(赤色シグナル)において再構成GFP由来の緑色シグナルが観察された。図中のスケールバーは50 μmを示す。
そこで、sGRAPHICが分泌性のタンパク質を介した細胞間相互作用メカニズムを解析できる可能性を示すために、マウスの疾患モデルで実証実験を実施しました。具体的には、sGRAPHICをマウス肝転移モデルに使い、マウスがん細胞株と肝実質細胞の相互作用の解析を試みました。マウスの肝臓に形成された転移病巣周辺では、がん細胞と肝実質細胞の相互作用により再構成されたGFPシグナルが確認されました(図3)。それらを破砕した肝組織から単離して、がん細胞に近い部位の肝実質細胞(GFPシグナル陽性)と遠い部位の肝実質細胞(GFPシグナル陰性)の発現する3000種程度の遺伝子の発現パターンの違いを1細胞RNAシーケンスによって比較解析した結果、がん細胞と相互作用する肝実質細胞では、分泌性の糖結合タンパク質であるgalectin-3遺伝子の発現上昇が認められました。実際にマウスの肝転移組織において、がん細胞と肝実質細胞が接触する部位でgalectin-3タンパク質の存在が免疫組織染色によっても確認できました(図4)。これらの結果は、がん細胞と肝実質細胞がgalectin-3を介して細胞間相互作用し、転移病巣の形成に寄与する可能性を示唆するものです。
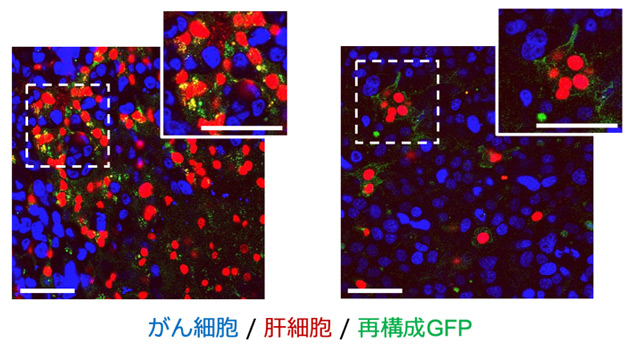
図3. 肝転移病巣でのsGRAPHIC標識
マウスの肝転移病巣におけるがん細胞と相互作用する肝実質細胞をsGRAPHIC標識した。青色シグナルと赤色シグナルはそれぞれがん細胞と肝実質細胞の細胞核を、緑色シグナルは再構成GFPの存在を示す。図中のスケールバーは50 μmを示す。
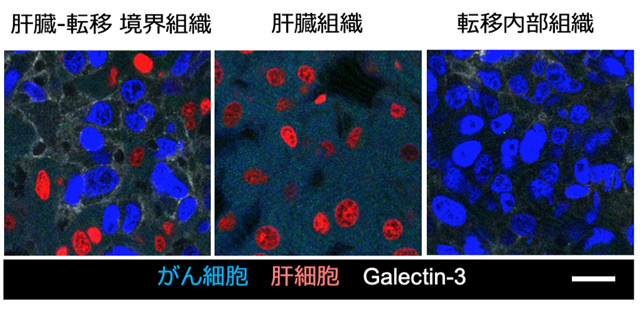
図4. galectin-3の免疫組織染色
肝転移が形成された肝臓組織において、肝組織と転移組織の境界領域、転移から遠位の肝組織に加えて、転移の内部組織におけるgalectin-3由来の蛍光シグナルを観察した。青色シグナルと赤色シグナルはそれぞれがん細胞と肝実質細胞の細胞核を、白色シグナルはgalectin-3タンパク質の存在を示す。図中のスケールバーは20 μmを示す。
sGRAPHICを使って、がんだけでなく様々な疾患に関わる細胞間相互作用メカニズムの理解が進むことが期待できます。例えば、心炎症組織に集まってくる免疫細胞群は様々な細胞との相互作用を介して、炎症の重篤化を促進することなどが示唆されています。今後、そのような病態解析に基づく治療法の確立を目指して、sGRAPHICの技術実装を進めます。また、本研究では、従来のGRAPHICが、がん細胞では期待通りに機能しないという予想外の結果から、sGRAPHICの開発に至りました。一方で、細胞同士の近接状態は非常に多様であり、sGRAPHICでも十分に捉えることができない細胞間相互作用の存在も明らかになりつつあります。今後、様々な性質の細胞間相互作用をより簡便かつ効率的に解析するための技術開発は、疾患のメカニズムを解明する上でますます意義深い試みとなると思われます。
付記
本研究は、科学研究費助成事業(JP17H04989、JP19H04814、JP20H02862、JP20J15062、JP21K18194、JP22J00672)、科学技術振興機構 戦略的創造研究推進事業(CREST)「多細胞間での時空間的相互作用の理解を目指した定量的解析基盤の創出」研究領域における研究課題「RNA movieによる多細胞運命分岐のダイナミクスアノテーション」(JPMJCR2124)、日本医療研究開発機構 革新的先端研究開発支援事業(PRIME)「生体組織の適応・修復機構の時空間的解析による生命現象の理解と医療シーズの創出」研究開発領域における研究開発課題「酸素空間による心臓線維化誘導機構の解明と治療法開発」(JP20gm6210028)、公益財団法人車両競技公益資金記念財団、公益財団法人武田科学振興財団、公益財団法人吉田育英会の支援によって実施されました。
用語説明
[用語1] 再構成GFP : オワンクラゲから下村修博士によって単離された緑色蛍光タンパク質(GFP: green fluorescent protein)は、青色の光を吸収すると、緑色の蛍光を生成する発色機能を中心にすえた樽のような構造を持つタンパク質です。この樽型構造を二つのタンパク質断片に分割すると、GFPは蛍光を生成しなくなるが、分割断片が空間的に近接すると自律的に樽型構造が再構成され、蛍光性を獲得するという性質があります。この性質を利用して、それぞれの断片を相互作用する分子に結合して、分子間相互作用を再構成GFPの蛍光シグナルから検出するなどの応用技術に利用されてきました。
[用語2] 1細胞オミクス解析 : 1つの細胞に含有される生体分子を包括的に検出する技術です。細胞に含有される生体分子の量は微量なため、以前は包括解析には多量の細胞数が必要であったが、近年の技術進展により、RNAなどの核酸や代謝物に関しては1細胞レベルでの解析が実現しています。
[用語3] galectin-3 : 糖結合性のタンパク質の1つです。細胞外に分泌され、受容体タンパク質に結合するほか、細胞が接着する足場形成を支持することで、細胞の増殖を促したり、動きやすくしたりするなどの機能が知られています。
[用語4] GRAPHIC : 理化学研究所のグループによって開発された近接細胞の標識技術であり、GRAPHICはGlycosylphosphatidylinositol anchored Reconstitution-Activated Proteins to Highlight Intercellular Connectionsの略称として命名されました。GFP断片を相互作用する細胞それぞれの細胞膜の表面にペプチド鎖を介して提示し、細胞同士が十分に近づくと、GFPが再構成されます。細胞が強く接着して、細胞間距離が短くなる細胞間相互作用の検出に適しています。
[用語5] sGRAPHIC (secretory GRAPHIC) : 両方のGFP断片が細胞膜上に提示されるGRAPHICを改変し、一方のGFP断片を分泌することで、細胞膜上に提示されたもう一方のGFP断片と会合する、世界で初めての細胞外分泌様式を取り入れた再構成GFPシステムです。一方のGFP断片が物理的に細胞膜に結合していないので、相互作用細胞の標識効率が細胞間の厳密な距離に影響を受け難い特徴があります。
論文情報
掲載誌 : |
Nature Communications |
論文タイトル : |
Secretory GFP reconstitution labeling of neighboring cells interrogates cell–cell interactions in metastatic niches |
著者 : |
Misa Minegishi, Takahiro Kuchimaru*, Kaori Nishikawa, Takayuki Isagawa, Satoshi Iwano, Kei Iida, Hiromasa Hara, Shizuka Miura, Marika Sato, Shigeaki Watanabe, Akifumi Shiomi, Yo Mabuchi, Hiroshi Hamana, Hiroyuki Kishi, Tatsuyuki Sato, Daigo Sawaki, Shigeru Sato, Yutaka Hanazono, Atsushi Suzuki, Takahide Kohro, Tetsuya Kadonosono, Tomomi Shimogori, Atsushi Miyawaki, Norihiko Takeda, Hirofumi Shintaku*, Shinae Kizaka-Kondoh, Satoshi Nishimura *corresponding authors |
DOI : |
お問い合わせ先
東京工業大学 生命理工学院 生命理工学系
特定教授 近藤科江
Email kondoh.s.ac@m.titech.ac.jp
自治医科大学 分子病態治療研究センター 循環病態・代謝学研究部
准教授 口丸高弘
Email kuchimaru@jichi.ac.jp
Tel 0285-58-7312
取材申し込み先
東京工業大学 総務部 広報課
Email media@jim.titech.ac.jp
Tel 03-5734-2975 / Fax 03-5734-3661
自治医科大学 大学事務部 研究支援課
Email shien@jichi.ac.jp
Tel 0285-58-7550
理化学研究所 広報室 報道担当
Email ex-press@ml.riken.jp
Tel 050-3495-0247