東工大ニュース
東工大ニュース
公開日:2016.10.18
東京工業大学 生命理工学院 生命理工学系の近藤科江教授と口丸高弘助教らは、腫瘍組織に存在する悪性化したがん細胞を非侵襲的に可視化することに成功した。悪性がん細胞で活性化する低酸素誘導因子[用語1]に応答して、近赤外発光[用語2]を生成するイメージングプローブ[用語3](POL-N)を開発して実現した。このイメージングプローブはユビキチン-プロテアソーム系(UPS)[用語4]による低酸素誘導因子の分解制御機構と、近赤外生物発光分子を組み合わせたタンパク質分子であり、血中に投与するだけで、高感度かつ迅速に腫瘍組織の低酸素誘導因子を発光できた。
低酸素誘導因子は多くの腫瘍組織で活性化が認められ、薬剤抵抗性や転移といった悪性化に関わることが報告されており、治療標的や診断マーカーとして有望な分子である。これまで、腫瘍組織における低酸素誘導因子の活性化を非侵襲的に可視化するためには、がん細胞やマウスに前もって遺伝子を導入する必要があり、その場観察は困難だった。開発したイメージングプローブは、外部から生体に血中投与した後、低酸素誘導因子が活性化したがん細胞内に蓄積され、生体組織透過性の高い近赤外発光シグナルを生成することで悪性化したがん細胞を可視化する。マウスを用いたがんの悪性化機構に関する研究を加速させるとともに、低酸素誘導因子が関わる多くの疾患研究に有用なツールとなる。研究成果は10月4日発行のネイチャー・パブリッシンググループのオンラインジャーナル「Scientific Reports」に掲載された。
イメージングプローブは、低酸素誘導因子が活性化していない細胞に取り込まれると即座に分解され発光シグナルを生成しないが、低酸素誘導因子活性化細胞においては安定化し、生体組織透過性に優れる近赤外発光を生成する(図1)。イメージングプローブを、皮下腫瘍が形成されたマウスに尾静脈から全身投与したところ、従来の蛍光プローブに比べ、非常に短時間(投与後1時間)かつ高感度に、腫瘍組織の低酸素誘導因子が活性化した悪性がん細胞の非侵襲的な可視化に成功した(図2)。また、これまでの蛍光イメージングでは膀胱、肝臓や腎臓といった臓器で排泄過程にあるイメージングプローブが長時間にわたって強い光シグナルを発してしまい、高感度なイメージングが困難であった、大腸がんの肝転移病巣における低酸素誘導因子活性の検出が可能であることを示した(図3)。
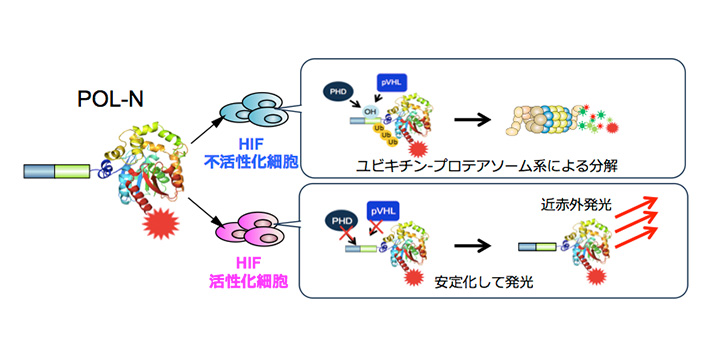
図1. イメージングプローブによる低酸素誘導因子活性化細胞の可視化機構
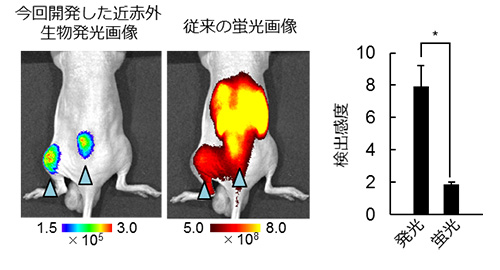
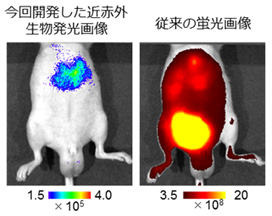
図3. 低酸素誘導因子が活性化した肝転移病巣のイメージングの違い
従来の蛍光画像では、膀胱より排せつ途中の蛍光色素からの非特異的なシグナルが強すぎて、肝臓がんをイメージすることができない。
細胞の低酸素応答を司る転写因子低酸素誘導因子は、多くの腫瘍組織で活性化して、薬剤抵抗性や転移といった、がんの悪性化に関わることが知られている。低酸素誘導因子は、有酸素下では、UPSによって選択的に分解されているが、腫瘍内低酸素環境[用語5]ではUPSの分解をのがれ、がん細胞の悪性化を促す多くの遺伝子の制御に関わる。多くの腫瘍悪性化マーカー分子と異なり、低酸素誘導因子は幅広いがん種において悪性化に関わっていることから、がん細胞が低酸素誘導因子の活性化を介して悪性化する分子機構や、治療・診断薬の開発まで活発な研究が世界中で進められている。
これまで、腫瘍組織の低酸素誘導因子の活性化を可視化するためには、準備に長期間を要する細胞や動物への遺伝子導入が必要であった。それを克服するために、その場で血中に投与可能な蛍光分子を用いた機能性材料によるイメージング手法が試行されてきたが、蛍光シグナルの制御が難しく、検出感度が十分でないことに加え、検出までに長時間を要していた。
今回の研究では、これまでの蛍光イメージングプローブの欠点を解消するため、光シグナルの精密な制御が可能な生物発光タンパク質ウミシイタケルシフェラーゼ(Rluc)を利用した。しかし、Rlucが生成する最大発光波長は547 nm(ナノメートル)と、生体組織に吸収されやすく、生体組織の非侵襲イメージングには不向きであった。そこで、Rlucに近赤外蛍光色素を結合し、生物発光共鳴エネルギー移動[用語6]を介して最大発光波長を702 nmに長波長化することで、この問題を解決した。
POL-Nイメージングプローブを用いて発がんや転移過程における低酸素誘導因子の役割を明らかにしていく予定である。また、イメージングプローブの分子設計は、低酸素誘導因子に限らず、UPSで制御される様々な分子活性を可視化するイメージングプローブの開発に利用可能であり、今後、多くのイメージング材料の開発に貢献することが期待される。
用語説明
[用語1] 低酸素誘導因子(HIF, hypoxia-inducible factor) : 細胞が低酸素環境に晒されると安定化し、転写活性を介して細胞の低酸素応答を司る分子。
[用語2] 近赤外発光 : 650 nmよりも長い波長を有する発光。
[用語3] イメージングプローブ : 特定の標的を可視化する材料の総称。
[用語4] ユビキチン-プロテアソーム系(UPS, ubiquitin-proteasome system) : 細胞内のタンパク質を特異的に認識して分解する機構。
[用語5] 腫瘍内低酸素環境 : 不完全な血管形成とがん細胞の過増殖によって慢性的な酸素欠乏に陥った環境。
[用語6] 生物発光共鳴エネルギー移動 : 生物発光反応によって生成されたエネルギーが近傍の蛍光物質に移動する現象。
研究サポート
この研究は、新学術領域「がん微小環境ネットワークの統合的研究」と日本学術振興会の特別研究員奨励費の支援を受けて実施した。
論文情報
掲載誌 : |
Scientific Reports |
論文タイトル : |
A novel injectable BRET-based in vivo imaging probe for detecting the activity of hypoxia-inducible factor regulated by the ubiquitin-proteasome system. (ユビキチンプロテアソーム系により制御されている低酸素誘導因子活性を検出する新規投与型生体イメージングプローブ) |
著者 : |
Takahiro Kuchimaru, Tomoya Suka, Keisuke Hirota, Tetsuya Kadonosono, Shinae Kizaka-Kondoh |
DOI : |
お問い合わせ先
東京工業大学 生命理工学院 生命理工学系
教授 近藤科江
E-mail : skondoh@bio.titech.ac.jp
Tel / Fax : 045-924-5800
取材申し込み先
東京工業大学 広報センター
E-mail : media@jim.titech.ac.jp
Tel : 03-5734-2975 / Fax : 03-5734-3661