東工大ニュース
東工大ニュース
公開日:2019.02.08
京都大学化学研究所 緒方博之 教授、京都大学理学研究科 吉川元貴 博士課程学生、東京理科大学 武村政春 教授、生理学研究所 村田和義 准教授、東京工業大学 地球生命研究所(ELSI) 望月智弘 研究員らの共同研究チームが、アメーバに感染する新規巨大ウイルスを発見しました。メドゥーサウイルスと名づけられたこの巨大ウイルスは、全セットのヒストン遺伝子をゲノム内に保持しており、特異な粒子形態とゲノム組成から新たな「科」に属することが明らかになりました。ヒストンは真核生物がDNAを折り畳んで核内に収納するために必須な5種類のタンパク質で、その一部を持つウイルスはこれまでに知られていました。しかし、ヒストン遺伝子全セットを保持するウイルスはメドゥーサウイルスが初めてです。真核生物のDNA関連遺伝子がウイルスに由来するという仮説が提唱されていますが、本研究成果はそうした仮説を支持する結果と考えられます。今後、ウイルスヒストンの役割などメドゥーサウイルスの感染過程を分子レベルで解明することにより、巨大ウイルスと真核生物の太古以来の共進化誌が紐解かれるのではないかと期待されます。
本研究成果は、2019年2月6日に米国の国際学術誌「Journal of Virology」にオンライン掲載されました。
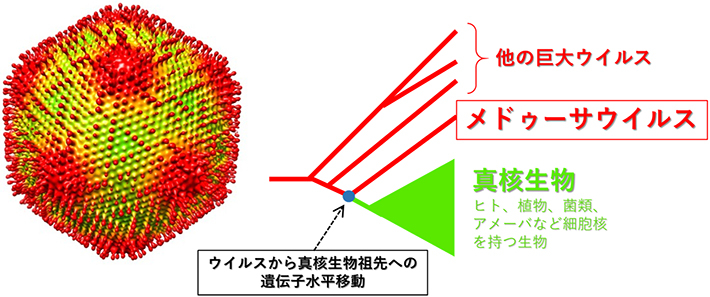
図1. 左はメドゥーサウイルスの粒子構造。右はヒストン遺伝子やDNA複製酵素の系統樹の模式図。真核生物の系統樹の根本からウイルスの遺伝子の系統が派生している。DNA複製酵素(真核生物のDNAポリメラーゼδ)遺伝子やヒストン遺伝子は、遺伝子水平移動によってウイルスから真核生物にもたらされたのかもしれない。
今世紀初頭、生物学の常識を覆すウイルスが発見されました。ミミウイルスと呼ばれるそのウイルスは、単細胞真核生物(原生生物)であるアメーバを宿主として増殖します。粒子サイズとゲノム長で数多くの単細胞生物を凌ぐ大きさと複雑さを誇るミミウイルスの発見は、「ウイルスは小さくて単純なものだ」という生物学者の固定観念を覆し、大きなインパクトを与えました。ミミウイルスの発見を端緒に、世界中の研究者が巨大ウイルスハンティングを開始し、パンドラウイルス、ピソウイルス、マルセイユウイルスなど様々な巨大ウイルスの発見が相次ぎ、日本では東京理科大学 武村政春教授らのグループにより、トーキョーウイルス(マルセイユウイルスの仲間)やミミウイルス・シラコマエ(ミミウイルスの仲間)などの発見がなされました。
こうした巨大ウイルスは調べれば調べるほど、その生き生きとした多様で複雑な「生き様」が伺え、その結果、「ウイルスは生命なのか?」といった根本的疑問が沸き上がると同時に[参考文献1]、ウイルスは細胞から進化したのではないか[参考文献2]、ウイルスがDNAを発明したのではないか[参考文献3]、細胞核はウイルス由来ではないか[参考文献4]という挑戦的かつ挑発的な仮説が提唱されました。
今回、共同研究チームは、北海道にある温泉地域の湯溜まりとその水底の泥土サンプルから、アメーバを宿主として新しい巨大ウイルスを分離し、その感染過程、粒子構造、ゲノム組成の詳細を調査しました。その結果、この巨大ウイルスが、これまでに知られていた巨大ウイルスと多くの点で異なることが明らかになりました。
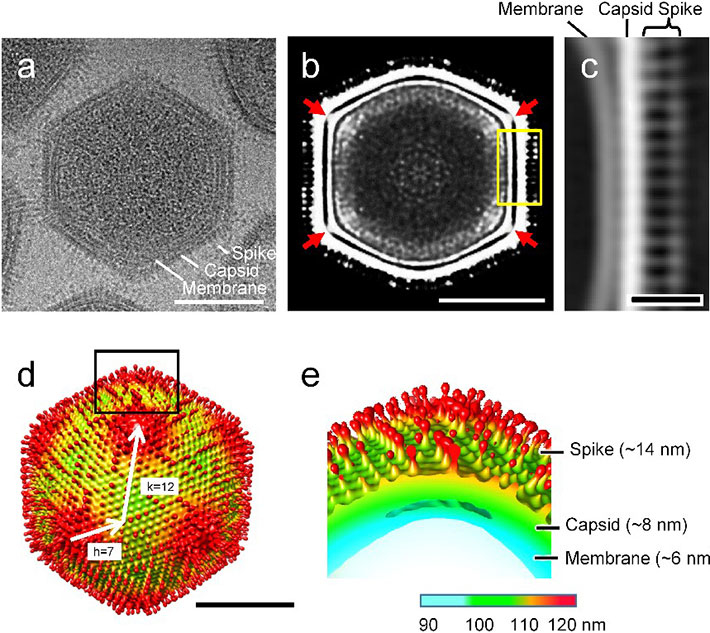
図2. メドゥーサウイルス粒子のクライオ電子顕微鏡による単粒子解析
(a)クライオ電子顕微鏡で見たメドゥーサウイルス粒子。(b)3D構築した粒子の断面図。赤矢印は核を覆う脂質二重膜がカプシドと結合している部分を表す。(c)図bの黄色い四角部分の拡大図。(d)単粒子解析による3D構築した粒子像。白矢印は粒子の大きさ(T=277)を算出するためのk値、h値。(e)図dの黒い四角部分を切り出した拡大図。
新規巨大ウイルスはアメーバを宿主として増殖しますが、感染過程で一部のアメーバ細胞が厚い膜を被り休眠状態に入る(シスト化する)ことが明らかになりました。これが、見たものを石に変える能力を持つギリシア神話の怪物「メドゥーサ」をイメージさせることから、この新規巨大ウイルスをメドゥーサウイルスと名づけました。
メドゥーサウイルスは、粒子径が260ナノメートル、ゲノム長が38万塩基対とこれまでに記録されている巨大ウイルスの中では小型の巨大ウイルスでした。しかし、クライオ電顕単粒子解析により、先端が球状のスパイクでウイルス粒子表面が覆われているなど、独特の粒子形態が浮き彫りになりました。ゲノムの遺伝子組成にも特徴があり、ゲノム内の461個のタンパク質遺伝子のうちなんと61%(279個)が、データベースに類似した遺伝子がない新規遺伝子であることが判明しました。また、感染過程の観察から、ウイルスゲノムの複製がアメーバの細胞核内で完了していることも伺え、これまでに報告されてきた巨大ウイルスとは様相を異にしていました。こうした結果と遺伝子解析(分子系統解析)の結果を総合し、共同研究チームは、メドゥーサウイルスが新しい「科(family)」つまり「メドゥーサウイルス科」に属するウイルスだと結論しました。「科」はウイルスの分類体系において事実上最上位の分類群です。
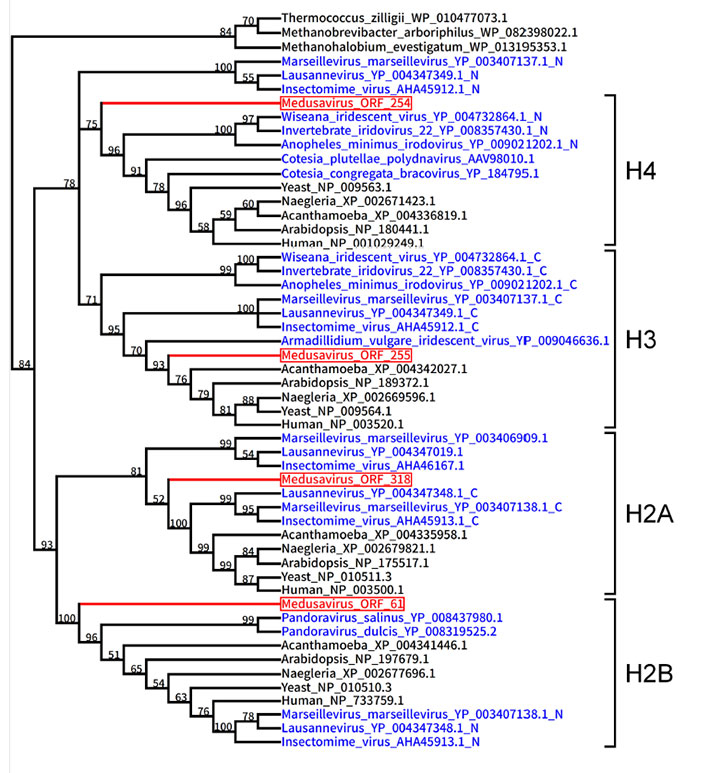
図3. ヒストン遺伝子の系統樹
赤:メドゥーサウイルス、青:その他のウイルス、黒:ヒトを含む真核生物と古細菌。
メドゥーサウイルスのゲノムで最も際立った特徴は、ヒストン遺伝子を全セット(ヒストンH1, H2A, H2B, H3, H4の5種類)保持していたことです。これまでにマルセイユウイルスやパンドラウイルスがヒストン遺伝子の一部を保持していることは知られていましたが、ヒストン遺伝子全セットを保持するウイルスはメドゥーサウイルスが初めてです。ウイルス粒子からもウイルス由来のヒストンタンパク質が検出されました。分子系統解析の結果はさらに興味深いものでした。これらのヒストン遺伝子はその進化の枝が、真核生物の系統樹の根っこの部分から派生しており、その起源が真核生物の共通祖先よりも古いことが明らかになりました。つまり、ウイルスのヒストン遺伝子は、真核生物の特定の系統から獲得されたものではないのです。このことは、真核生物の先祖がヒストン遺伝子を古代のウイルスから獲得した可能性を示唆しています。同様の進化シナリオがメドゥーサウイルスのDNA複製酵素遺伝子の解析からも浮き彫りになりました。
さらに、アメーバとメドゥーサウイルスのゲノム比較から、進化の過程で数多くの遺伝子の受け渡し(遺伝子水平移動)が両者の間で起こっていたことも明らかになりました。遺伝子の受け渡しの方向は、アメーバからウイルス、ウイルスからアメーバへの両方向の事例がありました。アメーバがウイルスから受け取った遺伝子の中にはウイルスの殻を作るためカプシドタンパク質遺伝子もありました。メドゥーサウイルスは、宿主と遺伝子をやり取りするのが得意なのかもしれません。
今後、研究チームは電子顕微鏡観察、トランスクリプトーム解析、プロテオーム解析、ウイルスタンパク質の生化学的解析などを利用し、ウイルスヒストンの役割など、メドゥーサウイルスの感染過程を分子レベルで解明することを目指しています。その結果、巨大ウイルスと真核生物の太古以来の共進化誌をさらに紐解くことができるのではないかと期待しています。
本研究は科研費(新学術領域提案型「ネオウイルス学」、基盤研究B)、生理研共同研究、京都大学化学研究所共同利用・共同研究の支援を受けて行われました。
論文情報
掲載誌 : |
Journal of Virology |
論文タイトル : |
Medusavirus, a novel large DNA virus discovered from hot spring water(メドューサウイルス―温水から発見された新規大型DNAウイルス) |
著者 : |
Genki Yoshikawa, Romain Blanc-Mathieu, Chihong Song, Yoko Kayama, Tomohiro Mochizuki, Kazuyoshi Murata, Hiroyuki Ogata, Masaharu Takemura |
DOI : |
参考文献
[1] Claverie J.-M., Ogata H. Ten good reasons not to exclude giruses from the evolutionary picture. Nat. Rev. Microbiol., 7, 615 (2009). doi: 10.1038/nrmicro2108-c3.
[2] Claverie JM. Viruses take center stage in cellular evolution. Genome Biol. 7, 110 (2006). doi: 10.1186/gb-2006-7-6-110.
[3] Forterre P. Three RNA cells for ribosomal lineages and three DNA viruses to replicate their genomes: a hypothesis for the origin of cellular domain. Proc Natl Acad Sci U S A. 103, 3669-3674 (2006). doi: 10.1073/pnas.0510333103.
[4] Takemura M. Poxviruses and the origin of the eukaryotic nucleus. J Mol Evol. 52, 419-25 (2001). doi: 10.1007/s002390010171.
お問い合わせ先
研究に関すること
緒方博之(おがた ひろゆき)
京都大学 化学研究所 教授
E-mail : ogata@kuicr.kyoto-u.ac.jp
Tel : 0774-38-3270
武村政春(たけむら まさはる)
東京理科大学 教授
E-mail : takemura@rs.kagu.tus.ac.jp
Tel : 03-5228-8373
村田和義(むらた かずよし)
生理学研究所 准教授
E-mail : kazum@nips.ac.jp
Tel : 0564-55-7872
望月智弘(もちづき ともひろ)
東京工業大学 地球生命研究所 研究員
E-mail : tomo.mochiviridae@elsi.jp
Tel : 03-5734-2678
取材申し込み先
京都大学 総務部広報課 国際広報室
E-mail : comms@mail2.adm.kyoto-u.ac.jp
Tel : 075-753-5729 / Fax : 075-753-2094
東京理科大学 研究戦略・産学連携センター(URAセンター)
E-mail : ura@admin.tus.ac.jp
Tel : 03-5228-7440 / Fax : 03-5228-7441
自然科学研究機構 生理学研究所 研究力強化戦略室
E-mail : pub-adm@nips.ac.jp
Tel : 0564-55-7722 / Fax : 0564-55-7721
東京工業大学 広報・社会連携本部 広報・地域連携部門
E-mail : media@jim.titech.ac.jp
Tel : 03-5734-2975 / Fax : 03-5734-3661