東工大ニュース
東工大ニュース
公開日:2020.01.30
JST 戦略的創造研究推進事業において、微生物化学研究所の野田展生部長、山﨑章徳博士研究員(現 東京工業大学 科学技術創成研究院 特任助教)らは、オートファジーはたんぱく質が液-液相分離[用語1]した液体状の会合体(液滴[用語2])を選択的に分解するのが得意である一方、凝集、固体化したたんぱく質の分解が不得手であることを発見しました。
オートファジーは細胞内のたんぱく質を分解する仕組みの1つであり、特定のたんぱく質やオルガネラを狙い撃ちして分解する「選択的オートファジー[用語3]」も知られています。選択的オートファジーは病原性のたんぱく質を分解することで疾病の発症を抑えていると考えられてきましたが、どのような状態のたんぱく質を効率的に分解できるのか、よく分かっていませんでした。
本研究グループは、酵母Ape1たんぱく質の選択的オートファジーをモデル系として用い、Ape1の脂質膜による隔離過程を試験管内で人為的に再構成することに成功しました。そしてApe1が液滴を作った時にAtg8たんぱく質と受容体たんぱく質の働きで効率的に脂質膜に隔離されること、一方で凝集、固体化したApe1では脂質膜に隔離されなくなることを明らかにしました。
選択的オートファジーがたんぱく質液滴の分解に長けている一方、たんぱく質凝集体の分解が不得手であるという今回の発見は、神経変性疾患の予防、治療薬の開発を進める上で、オートファジーの活性化だけでは不十分であり、凝集体を液滴状態へと変化させる薬剤開発が重要であることを提起するものです。
本研究成果は、2020年1月29日(米国時間)に米国科学誌「Molecular Cell」のオンライン速報版で公開されました。
本成果は、以下の事業・研究領域・研究課題によって得られました。
戦略的創造研究推進事業 チーム型研究(CREST)
研究領域: |
「ライフサイエンスの革新を目指した構造生命科学と先端的基盤技術」(研究総括:田中啓二 東京都医学総合研究所 理事長) |
研究課題名: |
「オートファジーの膜動態解明を志向した構造生命科学」 |
研究代表者: |
野田展生(微生物化学研究会 微生物化学研究所 部長) |
研究期間: |
平成25年4月~令和2年3月 |
オートファジーは酵母からヒトまで保存された細胞内の主要な分解経路であり、オートファゴソーム[用語4]と呼ばれる脂質膜の袋で分解対象を包み、分解の場であるリソソームへと輸送することで分解を行います。有害なたんぱく質凝集体や傷ついたミトコンドリアなどを狙い撃ちして分解するオートファジーも知られており、選択的オートファジーと呼ばれています。選択的オートファジーはさまざまな有害物や余剰物の分解を通して、細胞の恒常性維持に働いています。そしてその異常は神経変性疾患やがんなど、重篤な疾病を引き起こすことが知られています。
選択的オートファジーでは、特定のたんぱく質やオルガネラの表面でオートファゴソームの新生が進みます。その際、なるべく分解対象以外のたんぱく質やオルガネラが入らないように、オートファゴソームの前駆体(隔離膜)は分解対象と密着しながら伸長していきます。それぞれの分解対象にはそれを特異的に認識する受容体たんぱく質が存在することが知られており、受容体たんぱく質は隔離膜を覆っているAtg8たんぱく質と結合することで、分解対象を隔離膜に密着させる役割を担っていると考えられています。しかしながら隔離膜による分解対象の選択的な囲い込みが、Atg8たんぱく質と受容体だけで行えるのかどうかは分かっていませんでした。またたんぱく質は細胞内で液-液相分離し、液体状の会合体(液滴)を作ったり、それが固体化して凝集体になったりすることが知られていますが、選択的オートファジーがどのような状態のたんぱく質を標的にできるのか、これまでよく分かっていませんでした。
本研究グループは、出芽酵母Ape1たんぱく質の選択的オートファジーに着目し、まずApe1の性質について、蛍光顕微鏡を用いて酵母細胞内および試験管内で調べました。その結果、Ape1は試験管内で液-液相分離して液滴を作る性質があること(図1a中央)、さらに酵母細胞内でも液滴を作ることが分かりました。Ape1の選択的オートファジーでは、Atg19たんぱく質が受容体として機能することが知られています。Ape1液滴とAtg19の相互作用を調べた結果、試験管内および細胞内のどちらでもAtg19はApe1液滴表面に結合しました。一方、一部を欠いたAtg19変異体は、どちらの条件でもApe1液滴内部に浸潤することが分かりました。すなわちAtg19は浮輪のような領域を持っており、それによってApe1液滴内部に沈まずにApe1液滴の表面に集まる性質があることが分かりました(図1b)。
次に隔離膜によるApe1液滴の隔離過程を試験管内で再構成する実験を行いました。巨大脂質膜小胞にAtg8を結合させたのち、Ape1液滴とAtg19を添加したところ、Ape1液滴は脂質膜小胞に結合後、徐々に膜の嵌入を引き起こし、膜と密着しながら最終的に脂質膜小胞内へと取り込まれ、Ape1液滴の隔離過程は、Atg8と受容体Atg19だけで充分であることが分かりました(図1c)。またApe1液滴内部に浸潤するAtg19変異体を用いた場合、隔離は進行しなかったことから、Ape1液滴表面をAtg19が覆っていることが隔離のために重要と考えられます。
これまでの報告で、選択的オートファジーの標的とならなくなるApe1変異体がいくつか知られていました。そのうちの1つであるP22L変異体(Ape1のプロリン22番がロイシンに置換したもの)の性質を調べたところ、球状の液滴を形成せずに不定形の凝集体を形成することが分かりました(図1a右)。高速原子間力顕微鏡[用語5]で調べたところ、Ape1液滴の表面は活発に動いているのに対し、P22L変異体の凝集体表面は動きがほとんどなくなっていることが分かりました。そしてP22L変異体はAtg19存在下では、Atg8を結合させた脂質膜小胞により隔離されず、選択的オートファジーの標的となるためにはApe1は凝集体ではなく液滴を形成することが重要であることが分かりました(図1d)。
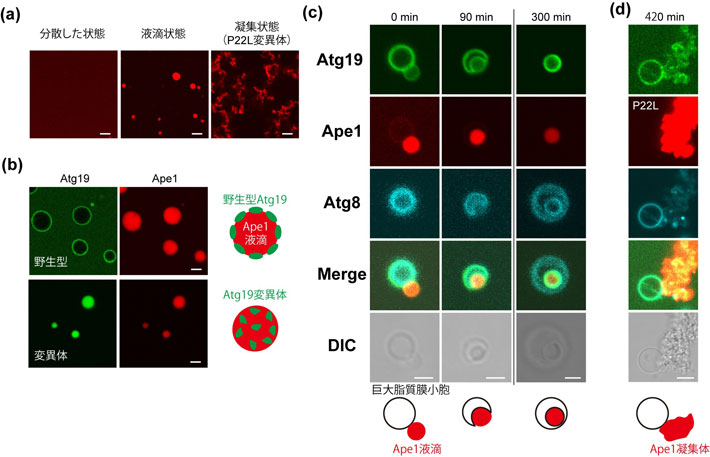
図1. たんぱく質液滴選択的オートファジーの試験管内再構成
これらの結果は、選択的オートファジーは流動性を持った液滴状態のたんぱく質の分解を得意とする一方、流動性のない凝集状態のたんぱく質の分解は苦手であることを強く示唆しています(図2)。そして液滴状態のたんぱく質を効率よく認識するために、受容体は液滴内部に沈まない性質を持つことも分かりました。これまで選択的オートファジーは細胞にとって有害なたんぱく質凝集体を分解すると信じられてきましたが、実際はそれが苦手であり、凝集体化する前段階である液滴状態のたんぱく質を主に分解していると考えられます。
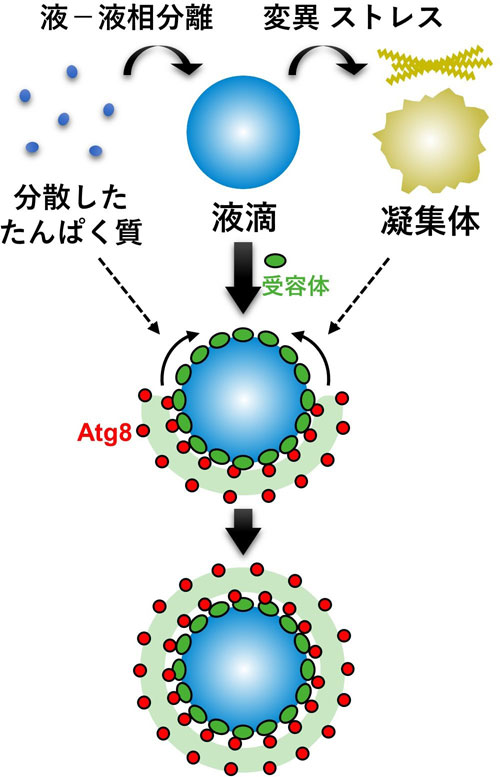
図2. 選択的オートファジーは液滴を効率的に分解する
たんぱく質は分散した状態から液-液相分離することで液滴を形成する。液滴は高い流動性を持ち、固体よりも液体に近い性質を持つ。液滴は変異やストレス、時間経過などを経て流動性を失っていき、凝集体やアミロイド線維などへと変化することが知られている。選択的オートファジーは流動性の高い液滴の分解が得意であり、その際は受容体が液滴表面に集積し、隔離膜上のAtg8と結合することで、液滴表面に沿った隔離膜の伸長を可能にする。一方、選択的オートファジーは流動性を失った固体状態の凝集体や分散したたんぱく質の分解は不得手である。
選択的オートファジーはたんぱく質液滴の分解を得意としており、たんぱく質凝集体の分解が不得手であるという今回の発見は、これまでのオートファジーを標的とした創薬の考え方を根底から変え得る成果です。神経変性疾患など、病原性たんぱく質の蓄積が原因と考えられている疾病の予防、治療薬の開発は、オートファジーをいかに活性化するかに重点が置かれてきました。しかしながら今回の結果は、オートファジーの活性化だけでは不十分であり、病原性たんぱく質側をオートファジーにより分解されやすくするために液滴状態を保ったり、凝集状態から液滴状態へと変化させたりする薬剤の開発が重要であることを強く示唆するものです。従って液滴形成の仕組みである「液-液相分離」を標的とした創薬の発展が期待されます。
また、選択的オートファジーにおける標的たんぱく質の隔離のステップが、Atg8たんぱく質と受容体たんぱく質のみで行えることを初めて証明しました。オートファジーはミトコンドリアなどさまざまなオルガネラや病原性細菌なども選択的に分解しますが、これらについてもAtg8たんぱく質と受容体たんぱく質が同様のメカニズムで選択的隔離を担っている可能性が考えられます。さらに今回開発した試験管内再構成系を応用することで、さまざまな標的に関する選択的オートファジーのメカニズム研究が促進されることも期待されます。
本研究は、東京工業大学 大隅良典栄誉教授、東京大学 鈴木邦律准教授らと共同で行いました。
用語説明
[用語1] 液-液相分離 : 均一な溶液が複数の液相に分離する現象であり、日常生活でも水と油の分離としてよく観察される。細胞内ではたんぱく質や核酸が液-液相分離することが知られている。
[用語2] 液滴 : たんぱく質や核酸が液-液相分離することで形成した液体状の会合体。液滴は膜のないオルガネラとも呼ばれ、細胞内でさまざまな機能を担っている。液滴は自発的に球形になる性質があり、内部流動性が高く、周囲とも活発な分子交換を行うなどの性質を持つ。
[用語3] 選択的オートファジー : 飢餓が引き金となり細胞内成分を非選択的に分解する一般的なオートファジーとは異なり、細胞が必要な時に特定の対象を分解するオートファジー経路。選択的オートファジーでは、分解対象の種類に応じたさまざまな受容体たんぱく質が存在し、それらはどれも分解対象とオートファゴソーム上のたんぱく質Atg8の両方に結合することで、分解対象をオートファゴソームに選択的に取り込ませると考えられている。
[用語4] オートファゴソーム : オートファジーが誘導されると、細胞質に新たに作り出される二重膜のオルガネラ。オートファゴソームが取り囲んだもの(さまざまなたんぱく質やオルガネラなど)はすべて分解の場であるリソソーム(酵母の場合は液胞)へと輸送され、リソソーム内の分解酵素群の働きで分解される。
[用語5] 高速原子間力顕微鏡(高速AFM) : 原子間力顕微鏡(Atomic Force Microscope:AFM)は、探針と試料の間に働く原子間力を元に分子の形状を可視化する顕微鏡である。高速AFMは溶液中で動いているたんぱく質などの生体分子をナノメートルの空間分解能とサブ秒という時間分解能で観察することが可能である。
論文情報
掲載誌 : |
Molecular Cell |
論文タイトル : |
Liquidity is a critical determinant for selective autophagy of protein condensates (たんぱく質会合体の選択的オートファジーには、会合体の持つ流動性が重要である) |
著者 : |
山﨑章徳、Jahangir MD Alam、能代大輔、平田恵理、藤岡優子、鈴木邦律、大隅良典、野田展生*(*責任著者) |
DOI : |
大隅良典栄誉教授が「オートファジーの仕組みの解明」により、2016年ノーベル生理学・医学賞を受賞しました。受賞決定後の動き、研究概要をまとめた特設ページをオープンしました。
お問い合わせ先
微生物化学研究会 微生物化学研究所 構造生物学研究部
部長 野田展生
E-mail : nn@bikaken.or.jp
Tel : 03-3441-4173 / Fax : 03-6455-7348
東京工業大学 科学技術創成研究院 細胞制御工学研究センター
特任助教 山﨑章徳
E-mail : yamasaki.a.ae@m.titech.ac.jp
Tel : 045-924-5879
JST事業に関すること
科学技術振興機構 戦略研究推進部 ライフイノベーショングループ
川口哲
E-mail : crest@jst.go.jp
Tel : 03-3512-3524 / Fax : 03-3222-2064
取材申し込み先
科学技術振興機構 広報課
E-mail : jstkoho@jst.go.jp
Tel : 03-5214-8404 / Fax : 03-5214-8432
微生物化学研究会 微生物化学研究所 知的財産情報室
E-mail : office@bikaken.or.jp
Tel : 03-3441-4173 / Fax : 03-3441-5811
東京工業大学 広報・社会連携本部 広報・地域連携部門
E-mail : media@jim.titech.ac.jp
Tel : 03-5734-2975 / Fax : 03-5734-3661
東京大学 大学院新領域創成科学研究科 広報室
E-mail : info@edu.k.u-tokyo.ac.jp
Tel : 04-7136-5450