東工大ニュース
東工大ニュース
公開日:2020.04.27
東京工業大学 科学技術創成研究院の原亨和教授、元素戦略研究センター長の細野秀雄栄誉教授らは、50 ℃未満の温度で水素と窒素からアンモニアを合成する新触媒の開発に成功した。この触媒は豊富なカルシウムに水素とフッ素が結合した物質「水素化フッ素化カルシウム(CaFH)[用語1]」とルテニウム(Ru)ナノ粒子の複合材料「Ru/CaFH」で、室温で水素と窒素からアンモニアを合成できる。
原教授らはCaFHが低い温度で電子を与える力が強いことに着目し、その学理を低温でアンモニアを合成する触媒の開発に繋げた。アンモニア生産の大幅な効率化だけでなく、自然エネルギーを使った温室効果ガスのCO2排出ゼロにつながることが期待される。
アンモニアは肥料として世界人口の70 %の命を支える人類に必須の化学物質で、水素と空気中の窒素から触媒を介して生産する。しかし原料の水素はメタンなどの化石資源から作られるため、CO2排出は総排出量の3 %を越えている。
水から水素を作ればCO2排出問題は解決するかのようにみえるが、従来の触媒で水素と窒素からアンモニアを合成するには400 ℃近くの高温が不可欠。従来のアンモニア生産を自然エネルギー発電と繋げても発電量の大半はアンモニア生産に費やされ、十分な水素を作れない。水素と窒素からのアンモニア合成の温度を大幅に下げる触媒の開発はCO2排出ゼロのアンモニア生産への道を開く成果である。
本研究成果はネイチャーコミュニケーションズ(nature communications)オンライン速報版に4月24日に掲載された。
アンモニア(NH3)は触媒を介して水素(H2)と空気中の窒素(N2)から生産される化学物質であり、肥料として人口の70 %の生命を支えている。人類が最も多く生産する化学物質で、年間1億7千万トンに達する。このように、人類にとって重要なアンモニアだが、地球温暖化とともにその生産が大きな問題となっている。
それは、どこから水素を得るかということである。現在、アンモニアの原料となる水素は天然ガス、石炭、石油といった化石資源を燃やして生産している。その結果、膨大な量のCO2が排出され、総排出量の3 %を越えている。人口が増え続ける限り、化石資源が枯渇するまで、アンモニア生産に伴うCO2排出は増え続けることになる(図1)。
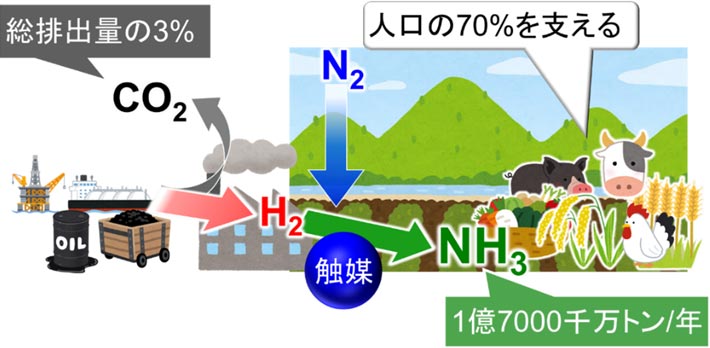
図1. 人類社会を支えるアンモニア生産と問題
CO2の排出なしに、アンモニアを生産する方法として、自然エネルギー発電の利用が考えられてきた(図2)。風力や太陽光発電によって水を電気分解すれば、CO2排出なしにクリーンな水素を得られる。この水素を原料にすればCO2排出なしに、そして化石資源の枯渇に怯えることなく、人類はアンモニアを手に入れることができる。
しかし、この手法には大きな問題がある。それは水素と窒素からアンモニアを合成する既存触媒は400 ℃程度の高温を必要とすることだ。電力で高温を生み出すには、かなりのエネルギーが必要になる。これは、自然エネルギーの発電量の大半を水素と窒素からのアンモニア生産に消費され、水の電気分解による水素生産に回せる電力が足りなくなるという本末転倒の結果になりかねない。自然エネルギー利用のアンモニア生産のシナリオを可能にするには、水素と窒素からアンモニアを合成する触媒の作動温度を大幅に低下させることが求められている。
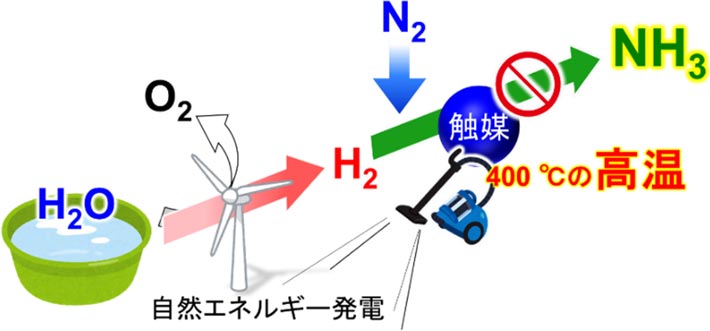
図2. 自然エネルギーによるアンモニア生産
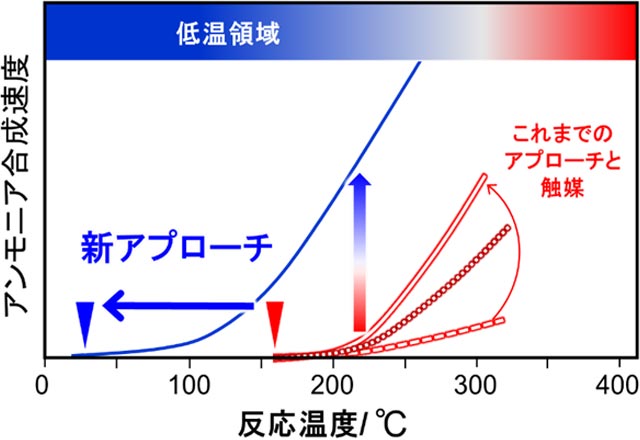
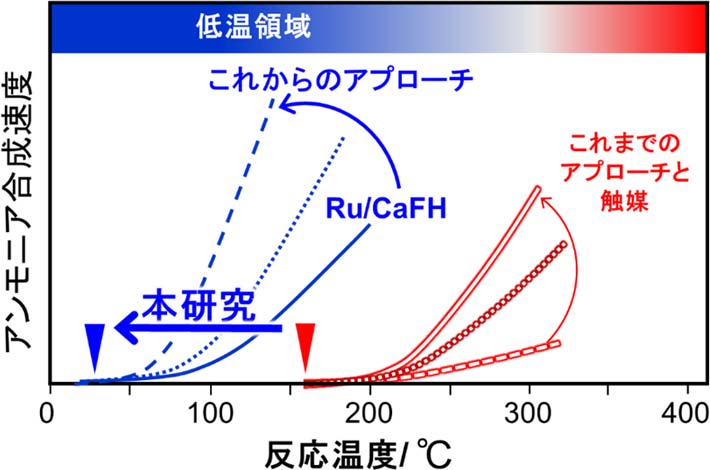
図3. アンモニア合成速度―反応温度曲線
このような背景の中、アンモニア合成触媒が大幅に低温で作動する新たなアプローチを原教授らが着想した。図3にアンモニア合成触媒の温度とアンモニア合成速度の関係を示す。砂糖を水に入れるより、お湯に入れた方が早く溶けるように、アンモニア合成速度も温度と共に速くなってくる。これまで、高い温度で高い性能を発揮する触媒は、低い温度でも、相応の高い性能を発揮すると考えられていた。しかし、原教授らの研究によって、これまで開発されてきたいずれの触媒も、100~200 ℃の間で作動しなくなることが明らかになった。
すなわち、従来のアプローチは、作動の起点を100~200 ℃とする傾きの異なる触媒を開発する取り組みで、傾きの大きな触媒が高性能な触媒とされてきた(図3赤線部分)。しかし、これでは高温での合成速度は速くなるが、低温での合成速度は速くはならず、大幅な低温化は実現できない。
本研究では、触媒の作動温度を50 ℃未満にスライドさせ、温度-アンモニア合成速度曲線自体を低温側に引き下げるアプローチを試みた(図3青線)。こうすれば、低温領域のアンモニア合成が著しく高くなるはずだが、これまで成功した事例はなかった。
上述のアプローチはこれまで試されたことがないため、何がこのアプローチに繋がるかは手探りの状態だった。原教授らは、まず低温で強く電子を与えることができる材料(電子供与材)の開発に着手した。アンモニア合成の最大の難関は窒素分子N2の窒素原子にまで分解する過程である。窒素分子は強固な結合によって結ばれた2つの窒素原子から成る安定な分子。この分子を原子にまで分解するには鉄などの遷移金属から窒素分子へ電子を一時的に与える必要がある(図4)。
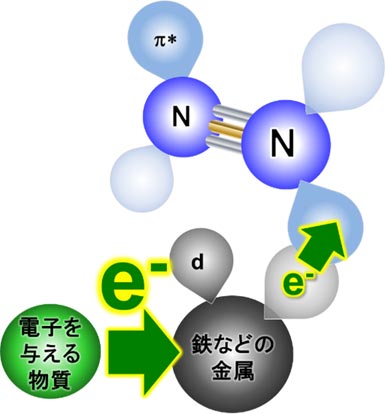
図4. 金属への電子供与による窒素分子の分解加速
しかし、遷移金属だけの電子供与は不十分であり、この電子供与をブーストするため、アンモニア合成触媒には金属に電子を与える物質、すなわち、電子供与材料が組み込まれている。100年以上も前から現在までアンモニアの大量生産に使われている鉄触媒では酸化カリウム(K2O)がこの電子供与材料に当たる。これまで様々な電子供与材がアンモニア合成触媒に組み込まれてきたが、既存の触媒では100~200 ℃で電子を与える力が弱まり、この温度領域で作動しなくなると原教授らは予想した。
そこで、ありふれた脱水材「水素化カルシウムCaH2」に着目した(図5)。CaH2はCa2+の陽イオンと水素の陰イオンH–(ヒドリドイオン)が結合したイオン性固体であり、200 ℃より高い温度にすると一部のH–が水素分子として抜け、電子をCa2+イオンの周りに残す(2H–→H2↑+ 2e–)。この状態の電子はアルカリ金属並みの電子供与能(大きなイオン化傾向)をもつため、この電子で遷移金属の電子供与をブーストすればN2分子は窒素原子まで分解できる。しかし、Ca2+—H–のイオン結合エネルギーが強いため、低温で使うことができない。
そこで、原教授らは大学の1年次で基礎として学ぶ古典的な学理を利用することにした。それはCa2+とより強い結合をつくる陰イオンを入れ、Ca2+—H–の結合エネルギーを弱めてしまうということである。Ca2+—F–の結合エネルギーはCa2+—H–のそれの2倍の強度をもつため、CaH2のヒドリドイオンの一部をF–で置き換え、水素化フッ素化カルシウムCaFHをつくれば、そのヒドリドイオンは低温で水素分子として脱離し、低温で強い電子供与能を発揮するはずである(図5)。実際に合成したCaFHでは室温程度からヒドリドイオンが水素分子として抜けることが確認された。
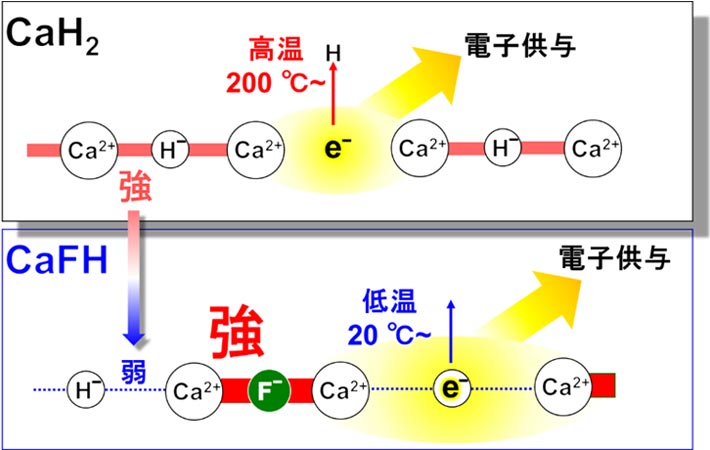
図5. CaH2、CaFHでの結合強度、水素引き抜き温度、電子供与

図6. Ru/CaFHの電子顕微鏡写真
図6はルテニウム(Ru)ナノ粒子-CaFH複合材触媒(Ru/CaFH)の電子顕微鏡写真である。この触媒はCaFHの下地(灰色)に直径数ナノメートルのRuナノ粒子(白色)が接合した固体材料である。この触媒は100 ℃以下でもアンモニアを合成し、50 ℃でさえ作動していることがわかった(表1)。これは50 ℃未満の温度でもアンモニアを合成できることを示唆している。実際、室温でもこの触媒は窒素分子からアンモニアを合成していることが分光法によって確認された。一方、現在のアンモニア生産に使われている商用の鉄触媒、そして、つい最近発表された最高性能の触媒、第2位の触媒は100 ℃以下の温度では全く作動しない。100 ℃以下の温度でRu/CaFHと比較するのは他の触媒にとって不公平なので、表2に200 ℃での結果を示す。200 ℃でのRu/CaFHは最高性能触媒の2倍を越えており、高い温度でも既存触媒を凌駕している。
図6はルテニウム(Ru)ナノ粒子-CaFH複合材触媒(Ru/CaFH)の電子顕微鏡写真である。この触媒はCaFHの下地(灰色)に直径数ナノメートルのRuナノ粒子(白色)が接合した固体材料である。この触媒は100 ℃以下でもアンモニアを合成し、50 ℃でさえ作動していることがわかった(表1)。これは50 ℃未満の温度でもアンモニアを合成できることを示唆している。実際、室温でもこの触媒は窒素分子からアンモニアを合成していることが分光法によって確認された。一方、現在のアンモニア生産に使われている商用の鉄触媒、そして、つい最近発表された最高性能の触媒、第2位の触媒は100 ℃以下の温度では全く作動しない。100 ℃以下の温度でRu/CaFHと比較するのは他の触媒にとって不公平なので、表2に200 ℃での結果を示す。200 ℃でのRu/CaFHは最高性能触媒の2倍を越えており、高い温度でも既存触媒を凌駕している。
なお、Ru/CaFHの活性化エネルギー[用語2]は20 kJ mol-1であり(表1)、これまで報告され現在のアンモニア生産にてできたアンモニア合成触媒の1/2程度にしか過ぎない。また、Ru/CaFHは安定な触媒であり、300 ℃を越える反応温度でも900時間以上アンモニア合成速度の低下なく、作動し続ける。
表1 Ru/CaFHの触媒性能(100 ℃以下)
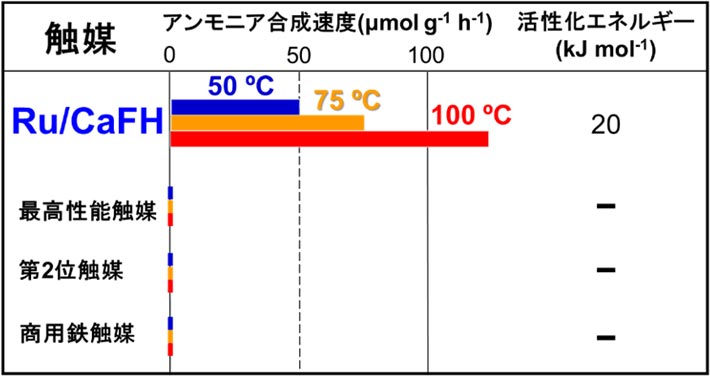
表2 Ru/CaFHの触媒性能(200 ℃)
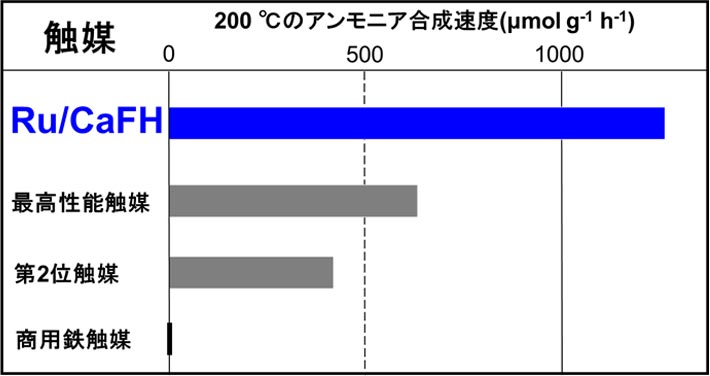
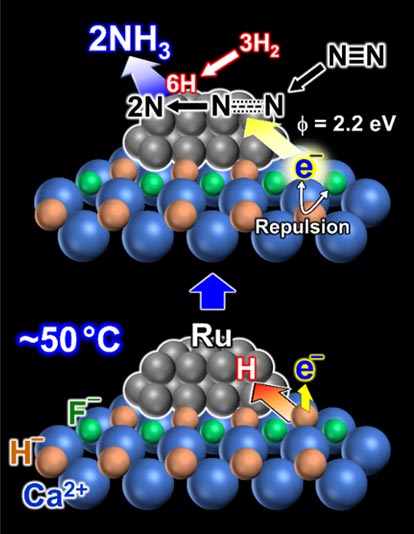
図7. Ru/CaFHの予想メカニズム
図7は様々な解析によって明らかにされたRu/CaFHのメカニズムである。まず、室温程度でCaFHから水素原子が抜け、電子を残していく。この状態でCaFHは金属カリウムと同等の強い電子供与力をもち、Ruへ強く電子を与える(図7下)。この状態のRuに窒素分子N2が接触すると、N2は直ちにN原子まで分解する。Ru表面には水素分子H2の分解によってH原子が生成しているので、窒素原子と水素原子は直ちに反応して、アンモニアNH3が生成する。この過程は室温でも進行することが明らかになった。
今回開発したRu/CaFHに2つの意味がある。
第一に、触媒の最低作動温度を引き下げるという新しいアプローチと、それを可能にする新たな触媒材料の開発によって300 ℃以下の低温領域のアンモニア合成触媒性能を著しく上げたこと。
第二に、100 ℃以下でも作動する触媒を生み出したこと。これまでの触媒は100 ℃以下では作動しない。従って、いかなる改良を施しても、100 ℃以下でアンモニアを合成することはできない。「0に何をかけても0にしかならない」からだ。一方、Ru/CaFHは室温程度でもアンモニアを合成できる。これまでの触媒がこれまでのアプローチによってその性能を向上してきたように、Ru/CaFH、あるいはその概念に基づく触媒の性能はまだまだ押し上がる余地が十分に残っている。
原教授のコメント
今回の研究に対する私たちの感想は、「社会が求めるアンモニア生産のきっかけを見つけた」に過ぎません。しかし、化石資源を使わずに肥料を生産し、人々に食糧を届けることが単なる夢想ではなくなり、現実味を帯びてきました。従来の触媒開発がしてきた性能向上をたどることによって、私達のアプローチ・触媒は真に地球・社会・人が求めるアンモニア生産に繋がると考えています。
論文情報
掲載誌 : |
nature communications |
論文タイトル : |
Solid solution for catalytic ammonia synthesis from nitrogen and hydrogen gases at 50 ℃ |
著者 : |
Masashi Hattori, Shinya Iijima, Takuya Nakao, Hideo Hosono, Michikazu Hara |
DOI : |
用語説明
[用語1] 水素化フッ素化カルシウム(CaFH) : 融雪剤である塩化カルシウムCaCl2はCa2+陽イオンに2つのCl–陰イオンが結合した固体のイオン化合物。CaFHは物質として既に知られていたが、材料として使われたことはない。なお、CaFHはフッ化カルシウムCaF2と水素化カルシウムCaH2の混合物を500 ℃以上で十数時間以上加熱することによって得られる。しかし、このようなCaFHを触媒に使っても、そのアンモニア合成速度は低い。高温で長時間の加熱がCaFHの焼結を進め、表面積が小さくなってしまうためだ(1 gのCaFHの面積は1 平方メートル未満)。そこで本研究では大きな表面積をもつCaFHを低い温度(200 ℃)・短い時間(3時間)で合成する全く新しい方法を開発した。この方法で合成した1 gのCaFHの面積は30平方メートルに達する。
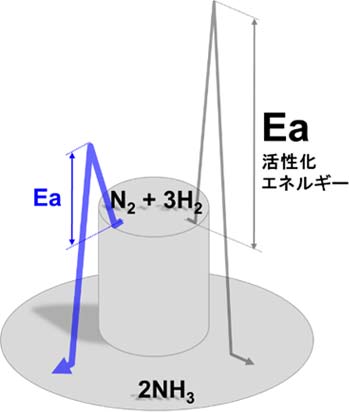
[用語2] 活性化エネルギー : 反応を進めるために必要なエネルギー。水素と窒素からアンモニアが生成する反応は発熱反応であり、丘の頂上から平地に下る反応である。しかし、丘の頂上は目に見えない塀で囲まれており、この塀を乗り越えないと丘を下ることはできない。この塀の高さが活性化エネルギーである。当然、塀の高さ、即ち活性化エネルギーが低い触媒ほど、反応が進みやすい。
[用語2] 活性化エネルギー : 反応を進めるために必要なエネルギー。水素と窒素からアンモニアが生成する反応は発熱反応であり、丘の頂上から平地に下る反応である。しかし、丘の頂上は目に見えない塀で囲まれており、この塀を乗り越えないと丘を下ることはできない。この塀の高さが活性化エネルギーである。当然、塀の高さ、即ち活性化エネルギーが低い触媒ほど、反応が進みやすい。
謝辞
本成果は、以下の事業・研究開発課題によって得られました。
日本学術振興会 科学研究費助成事業 基盤研究(S)
研究開発課題名: |
「電子供与の増幅による低温作動アンモニア合成触媒の開発」 |
研究代表者: |
東京工業大学科学技術創成研究院 原亨和 |
研究開発実施場所: |
東京工業大学 |
研究開発期間: |
2018年6月~2023年3月 |
お問い合わせ先
研究に関すること
東京工業大学 科学技術創成研究院 フロンティア材料研究所
教授 原亨和
E-mail : hara.m.ae@m.titech.ac.jp
Tel : 045-924-5311 / Fax : 045-924-5381
取材申し込み先
東京工業大学 総務部 広報・社会連携課
E-mail : media@jim.titech.ac.jp
Tel : 03-5734-2975 / Fax : 03-5734-3661