東工大ニュース
東工大ニュース
公開日:2021.12.14
東京工業大学 生命理工学院 生命理工学系の内野哲志大学院生(博士後期課程2年/科学技術創成研究院リサーチフェロー)、伊藤由馬助教(徳永万喜洋研究室)、科学技術創成研究院 細胞制御工学研究センターの木村宏教授らは、九州大学 生体防御医学研究所の大川恭行教授との共同研究により、遺伝子のRNAへの転写を担う酵素であるRNAポリメラーゼIIの活性化型を、生きた細胞の核の中で可視化する蛍光プローブの開発に成功した。具体的には、活性化型のRNAポリメラーゼIIはリン酸化されており、このリン酸化を選択的に観察することで、生きた細胞の核の中で転写が行われる場所の動態を明らかにできた。特に、転写の「開始」と「伸長」は、核の中でも別の場所で行われていることを示唆する観察結果が得られた。
本研究で開発したプローブは、遺伝子コード型であるため、遺伝子発現の研究に広く応用可能であり、組織や個体レベルでの転写制御解析への活用、生体における個体発生や病態変化に伴う遺伝子発現の制御機構の解明が期待される。
本研究成果は2021年12月2日、細胞生物学雑誌「Journal of Cell Biology」にオンライン掲載された。
生命を形作っている細胞においては、細胞の核の内部にある長大なDNAから、必要に応じて特定の遺伝子をRNAに読み取り(「転写」という)、その転写された遺伝情報を用いて、タンパク質を作り出す(「翻訳」という)作業が行われている(図1A)。ヒトなどの多細胞生物では、異なる機能を持つ多種類、かつ、数多くの細胞が働いているが、それらの中は、種類に応じて異なる遺伝子が読み取られ、異なるタンパク質が作り出されている。この転写から翻訳に至る遺伝子発現の過程をさかのぼり、それぞれの細胞において、どの遺伝子が発現するかをリアルタイムで観察できれば、その細胞の働き(機能)や形質がどのように維持・制御されているかを知ることができる。
多細胞生物の細胞核において、ほとんどの遺伝子の転写は、RNAポリメラーゼII(RNAP2)というタンパク質によって行われることが知られている。しかし、これまでの研究により、細胞核中に存在するRNAP2のうち、転写反応を行っているのは僅か20~25%程度であることが分かっている。そのため、蛍光タンパク質を融合したRNAP2を用いても、転写が行われている場所を追跡し特定することは困難だった。一方、転写に必要な活性化型のRNAP2は、C末端の繰り返し配列がリン酸化を受けており(図1B)、このリン酸化に特異的に結合する抗体を用いて化学固定した細胞(化学固定しているため生きてはいない細胞)を染色することで、転写中のRNAP2が検出できる。このような固定細胞を用いた免疫染色や転写直後のRNAの観察などから、転写は「転写ファクトリー」と呼ばれる核内の特定の場所で行われることが示唆されていた。転写される遺伝子は転写ファクトリーに集められ、転写の「開始」から「伸長」、「終了」まで、その過程に必要な一連の工程が効率よく進められるというモデルである。しかし、このような転写部位が生きた細胞内で実際に形成されているのかについては、不明だった。
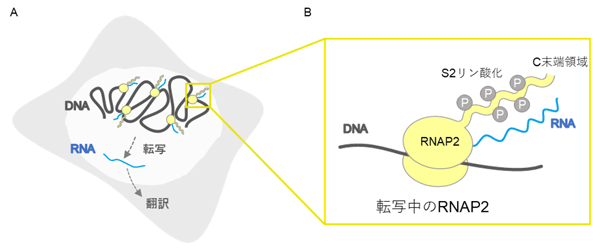
図1. 転写伸長型RNAポリメラーゼII(RNAP2)
(A)DNAの遺伝情報はRNAへ転写される。(B)RNAを転写中のRNAポリメラーゼII(RNAP2)は、C末端領域の繰り返し配列中の2番目のセリン(S2)がリン酸化を受けている。S2がリン酸化されたRNAP2を特異的に検出することで、転写の場所を検出することができる。
生きた細胞で活性化型RNAP2を特異的に検出するため、活性化の指標であるRNAP2繰り返し配列中の2番目のセリン(S2)のリン酸化(RNAP2 S2ph)(図1)に特異的な抗体をもとに、遺伝子コード型の生細胞プローブを開発した。このRNAP2 S2ph-mintbody(modification-specific intracellular antibody)と名付けられたプローブは、抗体の抗原結合部位を蛍光タンパク質と融合したもので、それをコードするDNAを細胞に導入することで、タンパク質として発現させることができる(図2A)。
抗体の多くは、その抗原結合部位を細胞内で安定に機能する形として発現させることができず、RNAP2 S2ph抗体の場合も18種類の中で機能したのは1つだけだった。また、その1つも安定性が十分でなかったため、いくつかのアミノ酸変異を導入して初めて実用化できた。
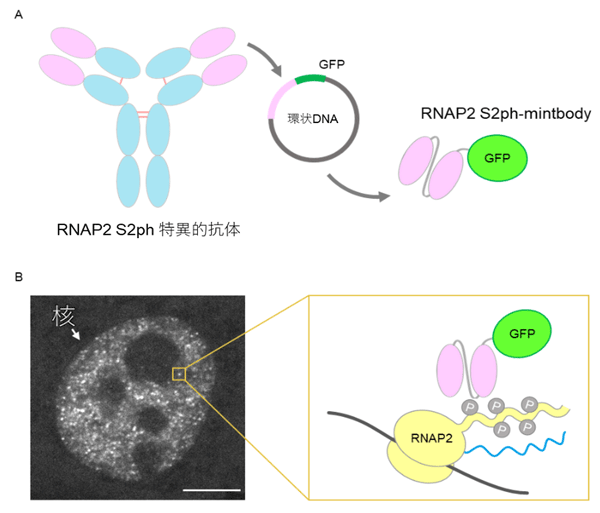
図2. mintbodyによる生きた細胞内の転写場所の可視化
(A)RNAP2 S2リン酸化(S2ph)修飾特異的生細胞プローブ。抗体の抗原結合にかかわる部位(可変領域、マゼンタ)のDNA配列に、蛍光タンパク質の配列を融合した。作製したRNAP2 S2ph-mintbodyをコードするDNAを細胞に導入すると、mintbodyが作られる。(B)生きたHeLa細胞核での転写の場所。RNAP2 S2ph-mintbodyの輝点に、RNAを転写中の活性化(S2リン酸化)型RNAP2が存在すると考えられる。スケールバーは5 µm。
開発したRNAP2 S2ph-mintbodyを生きたヒトHeLa細胞に発現させ、高解像度の共焦点顕微鏡で観察すると、核内で多数の輝点として検出できた。RNAP2 S2ph-mintbodyの輝点の数と大きさは、これまで固定細胞で解析された転写部位と類似していた。つまり、RNAP2 S2ph-mintbodyが、生きた細胞の中で転写部位を正しく検出していると推定できる。
また、それらの輝点は、細胞分裂時の染色体形成とともに消失し、細胞が2つに分裂して核が形成されたときに再び現れた。ヒト細胞では、細胞分裂時に転写が抑制されることから、RNAP2 S2ph-mintbodyの輝点は転写活性化されたRNAP2が存在する場所を正しく検出できていると推察した。このことを確認するため、細胞をRNAP2の転写伸長反応を阻害する薬剤やRNAP2の分解を促進する薬剤で処理したところ、RNAP2 S2ph-mintbodyの輝点は速やかに消失した。また、生化学的手法によってもRNAP2 S2ph-mintbodyの結合特異性が確認された。これらのことから、RNAP2 S2ph-mintbodyによって標識されている部位は、転写の場所であることが確認された(図2B)。
生きた細胞の核の中での転写の場所の性質を調べるために、RNAP2 S2ph-mintbodyとクロマチン[用語1]の動きを比較した。クロマチンは、凝縮し転写が抑制されているヘテロクロマチンと脱凝縮し転写されうるユークロマチンに大別されるが、RNAP2 S2ph-mintbodyの輝点(転写の場所)は、どちらのクロマチンよりも高い運動性を示した。また、RNAP2 S2ph-mintbodyの輝点と転写に関わる因子の局在との関係について解析したところ、RNAP2 S2ph-mintbodyの輝点は、転写の伸長に関係する因子と共局在する傾向がみられたのに対して、転写の開始に関係する因子とは離れて局在することが分かった。
これまで、「転写ファクトリー」では巨大な複合体中で転写の開始と伸長の両方が行われていると考えられていたが、本研究により、転写開始複合体形成の場所と実際に転写が行われている場所が異なることが示唆された(図3)。この知見は、生きた細胞内での転写の制御機構の基本原理の解明に一歩近づくものである。
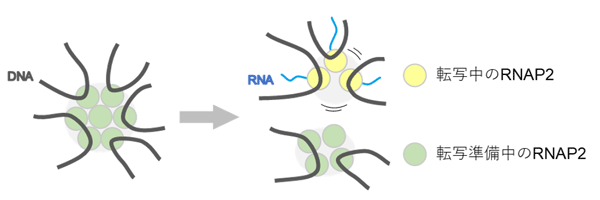
図3. 転写ファクトリー
転写が行われている場所(黄色)は細胞核内で動きやすく、転写準備(開始)中のRNAP2がいる場所(緑)とは異なっていると考えられる。
今回、生細胞で活性化型RNAP2のリアルタイム可視化に成功した。しかし、いつ、どこで、どのようにRNAP2がリン酸化を受けてRNAを転写しはじめるのか、転写を活性化させる因子はどのようにRNAP2のリン酸化に関与しているかなど、様々な疑問が残されている。今後も、生きた細胞内での動態解析を主軸に、転写制御機構の解明を行っていきたい。
また、本研究で開発したmintbodyプローブは遺伝子コード型であるため、そのプローブの遺伝子コードを組み込んだモデル生物を作製することができ、培養細胞だけでなく、組織や個体での転写活性化の検出も可能となる。このことは、今後、生体における個体発生や病態変化に伴う遺伝子発現の制御機構の解明に役立つと考えられる。
付記
本研究の成果は、運営費交付金、科学研究費助成事業[JP17H0417, JP17K17718, JP17KK0413, JP18H05527, JP19H03192, JP20H00456, JP20H04846, JP20K15755, JP20K06484, JP21H00232, JP21H04764]、科学技術振興機構 戦略的創造研究推進事業( CREST )[JPMJCR16G1, JPMJCR20S6]により得られたものである。
用語説明
[用語1] クロマチン : 真核生物の細胞核では、DNAはタンパク質と共に巨大な複合体として存在しており、この複合体をクロマチンと呼ぶ。
論文情報
掲載誌 : |
Journal of Cell Biology |
論文タイトル : |
Live imaging of transcription sites using an elongating RNA polymerase II–specific probe |
著者 : |
Satoshi Uchino, Yuma Ito, Yuko Sato, Tetsuya Handa, Yasuyuki Ohkawa, Makio Tokunaga, and Hiroshi Kimura |
DOI : |
お問い合わせ先
東京工業大学 科学技術創成研究院 細胞制御工学研究センター
教授 木村宏
E-mail : hkimura@bio.titech.ac.jp
Tel : 045-924-5742 / Fax : 045-924-5973
九州大学 生体防御医学研究所
教授 大川恭行
E-mail : yohkawa@bioreg.kyushu-u.ac.jp
Tel : 092-642-4534 / Fax : 092-642-6526
取材申し込み先
東京工業大学 総務部 広報課
E-mail : media@jim.titech.ac.jp
Tel : 03-5734-2975 / Fax : 03-5734-3661
九州大学 広報室
E-mail : koho@jimu.kyushu-u.ac.jp
Tel : 092-802-2130 / Fax : 092-802-2139