東工大ニュース
東工大ニュース
公開日:2022.01.25
東京工業大学 物質理工学院 材料系の福井慧賀大学院生、元素戦略研究センターの細野秀雄栄誉教授、物質・材料研究機構の飯村壮史主任研究員、横浜市立大学のイスカンダル・アルベルト特任准教授、九州大学の多田朋史教授の研究グループは、水素陰イオンである高濃度のヒドリドイオン(H−)[用語1]を含む、xの値を0.25未満に抑えた酸水素化ランタン(LaH3−2xOx)[用語2]を創出し、室温で世界最高のイオン伝導[用語3]度を達成した。
水素がイオン化する場合、通常は正の電荷をもつプロトン(H+)[用語4]となるが、負の電荷をもつヒドリドイオン(H−)にもなる。このヒドリドイオンは、還元力の高さやアミドやカルボン酸を水素化できる化学活性など、プロトンにはない独自の性質をもっている。
本研究における室温でのヒドリドイオン伝導度(~10−3 Scm−1)は従来に比べて1,000倍以上高く、プロトンの固体電解質の伝導度に匹敵する。ヒドリドイオンの高い還元能や化学反応活性を活かすことで、二酸化炭素等の再資源化を可能にする化学合成プロセスや高エネルギー密度の次世代電気化学デバイスへの応用が期待される。
本研究成果は1月24日(米国時間)に米国科学誌「Journal of the American Chemical Society」に速報として掲載された。
近年、水素が二酸化炭素を放出しないクリーンなエネルギーキャリアとして注目を集めている。
水素がイオン化する場合、通常は電子を失って正の電荷をもつ陽イオンのプロトン(H+)となる。このプロトンを利用する燃料電池や水の電解といった電気化学プロセスは、脱炭素社会における水素の製造と利用の両面を支えるキーテクノロジーと目され、盛んな研究開発が行われている。
一方、水素は電子を得ることにより、負の電荷をもつ陰イオンであるヒドリドイオン(H−)としても安定に存在できる。このヒドリドイオンはアミドやカルボン酸を水素化できる化学活性を有するため、有機合成における水素化剤として広く用いられてきた。
こうした独自の性質をもつヒドリドイオンを固体内で高速に動かし、高いイオン伝導度を実現できれば、難水素化物を原料に用いた燃料電池や、高出力の新規蓄電池など、まったく新しい機能を有する電気化学デバイスを実現できる。ただし、ヒドリドイオンは酸素イオンと同程度のサイズをもつため(~1.2 Å)、より小さなプロトン(« 0.01 Å)と比べて室温におけるイオンの伝導度が著しく低くなってしまい、材料開発におけるボトルネックとなっていた。
本研究者らは2019年により酸素量xの多い酸水素化ランタン(LaH3−2xOx,x ≥ 0.25)を用い、中温域にあたる350 ℃において、10−2 Scm−1を超える高いヒドリドイオン伝導度を達成している[参考文献1]。
LaH3−2xOxは酸素量xを減らし、水素を多く含む状態にすることによって、ヒドリドイオン伝導度が大きく向上するという性質をもつ。しかし、それにより水素が格子位置から欠損しやすくなるため、その際に生じる電子(H− = 1/2H2 + 電子)によって電子伝導[用語3a]度が増大し、イオン伝導度を正確に測定できていなかった。そのため、2019年の時点では酸素量xを0.25以上に設定した試料においてのみイオン伝導度を報告していた。そこで本研究では、水素の欠損を抑制しながら、酸素量xを0.25未満にごく低く抑えた水素リッチLaH3−2xOxの合成を試み、ヒドリドイオン伝導度の向上を狙った。
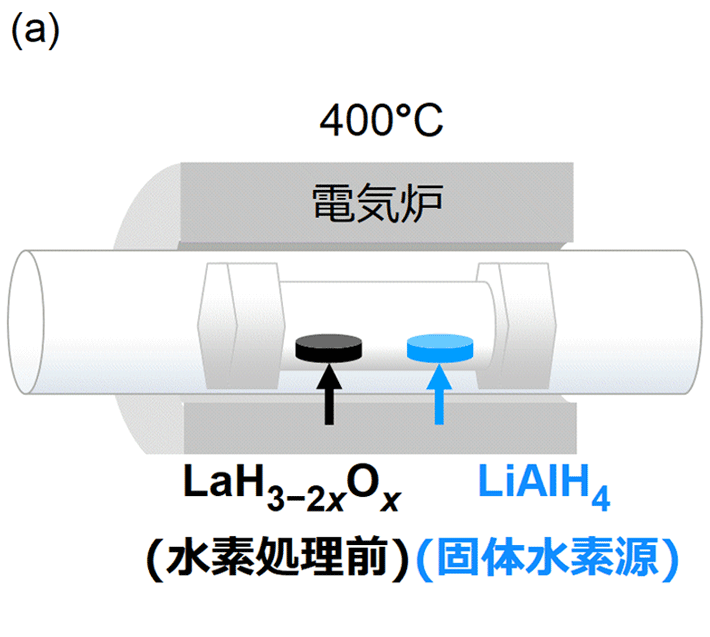
本研究では、酸素量xを0.25未満に抑えたLaH3−2xOx中に生じる水素の欠損を補うため、LaH3−2xOx合成後、水素源(水素ガスを発生する化合物)とともに400 ℃において再加熱をするという方法を採った。
最初に固相合成法[用語5]を用いて、酸素量xを0.1と0.2に低く抑えた水素リッチLaH3−2xOxを合成した。
次に、高温下で水素ガスを発生する固体の水素源としての水素化アルミニウムリチウム(LiAlH4)と、合成した水素リッチLaH3−2xOxをステンレス管の中に封じ、この管を400 ℃下で10時間加熱(図1a)。水素源から放出された水素ガスにより、管内の水素ガス圧を上げた。
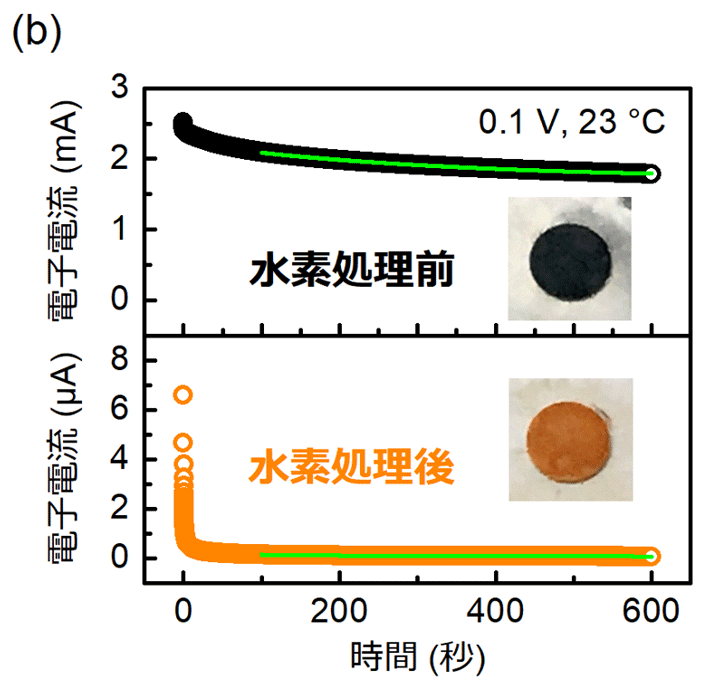
図1bは、この水素処理前後におけるLaH2.8O0.1(x = 0.1)の電子伝導度の時間依存性と、試料の写真である。水素処理前のLaH3−2xOx(図1b上側の黒色の試料)はmA(ミリアンペア)レベルの電流が流れるほどの高い電子伝導度を示し、多量の水素欠損に起因する強い光吸収によって黒色を示している。一方、水素処理を施すことで、電子伝導度は1万分の1以下にまで抑制され、色も鮮やかなオレンジ色に変化した。
次に、今回合成した2つの水素リッチLaH3−2xOx(x = 0.1、0.2)と、2019年の研究と同じx = 0.25のLaH3−2xOx、計3点の試料のヒドリドイオン伝導度の温度依存性を計測した。図2にその結果を示す。
x = 0.25とした2019年度と同じLaH3−2xOxの、室温(27 ℃)におけるイオン伝導度は、通常の装置では測定できないほど低かった(< 10−8 Scm−1)。一方、今回の水素欠損を補う処理を施したx = 0.1の水素リッチLaH3−2xOxでは、1 mScm−1を超え、非常に大きな伝導度の向上が見られた。
図2の実線は、水素の陽イオンである各種プロトン(H+)伝導体の伝導度を表している。今回得られた水素リッチ試料(LaH2.8O0.1, x = 0.1)の伝導度(~10−3 Scm−1)は水和物系のプロトン伝導度とほぼ同等であり、かつ、これまでに報告された最高の室温ヒドリドイオン伝導度である4−5×10−7 Scm−1と比べても1,000倍以上高い。
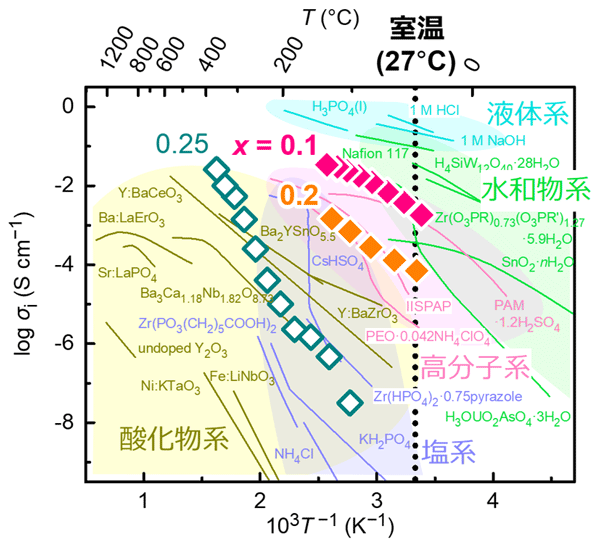
図2. ヒドリドイオンとプロトンの伝導度の温度依存性。
LaH3−2xOx中の酸素イオンを減らしたことによる室温イオン伝導度の急激な上昇は、活性化エネルギー[用語7]の減少に起因している。x = 0.25における活性化エネルギーは1.2 eVとイオン伝導体としては比較的大きな値を示す。一方、x = 0.1では0.3 eVとx = 0.25と比べて1 eVも減少する。
この原因を調べるため、第一原理計算[用語8]をもとに構築した機械学習ポテンシャル[用語9]を用いて、大規模な分子動力学シミュレーション[用語10]を行った。
拡散中のヒドリドイオンの位置を1ピコ秒(1兆分の1秒)ごとにスナップショットとして取得し、100ピコ秒まで重ねたものを図3に示した。青色で示したヒドリドイオンは酸素(赤色)から離れた場所に位置するヒドリドイオンを表しており、固体内を良く動き、互いの軌跡が連続的につながっていることが分かる。一方、灰色で示した酸素に近い場所のヒドリドイオンは、元の位置にとどまっており動けていない。すなわち、酸素量が多い試料では、ヒドリドイオンが酸素イオンの影響で初期の位置に束縛されてしまい、この束縛のエネルギー分だけイオン伝導に必要な活性化エネルギーが大きくなることを示している。
LaH3−2xOx中の酸素量が少なくなると、酸素から離れたヒドリドイオンの数が相対的に増えるため、図3に青色で示したようなイオンの高速伝導経路が形成される。この経路上を動くヒドリドイオンは、酸素の周りに束縛されないため、低い活性化エネルギーを維持したまま伝導できると考えられる。また、このヒドリドイオンが高速に拡散する過程では、近接する複数個のヒドリドイオンが互いを弾き合いながら長距離移動する挙動が観測されている。本結果は複数のヒドリドイオンの協調運動が高速伝導に重要な役割を担っていることを示唆していると考えられる。
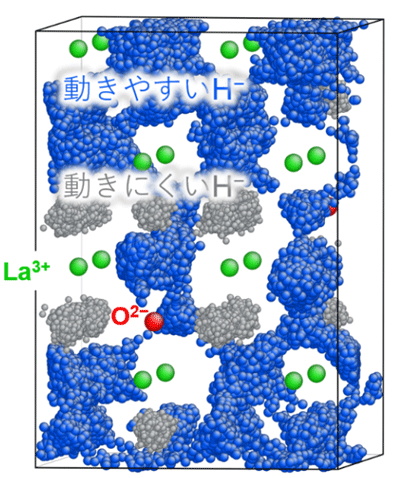
図3. 分子動力学シミュレーションから得た LaH2.75O0.125中におけるヒドリドイオンの拡散挙動(395 K)。
今回の結果から、ヒドリドイオン(H−)もプロトン(H+)と同様に室温でも高速に固体内を伝導できることが分かった。今後、電解合成反応器や高エネルギー密度の蓄電池の電解質に応用することで、二酸化炭素の再資源化など革新的な化学反応技術や従来にない物質生産プロセスの開拓、高出力なエネルギーデバイスの創出が期待される。
付記
本研究は、文科省元素戦略プロジェクト(研究拠点形成型)、および科学技術振興機構(JST)戦略的創造研究推進事業 さきがけ 研究領域「電子やイオン等の能動的制御と反応」の支援を受けて行われた。
用語説明
[用語1] ヒドリドイオン(H−) : 水素原子が電子1個を受け取ってイオン化した陰イオン。水素陰イオン(日本化学会命名法による正式名称は水素化物イオン)。
[用語2] 酸水素化ランタン(LaH3−2xOx) : ランタンと酸素、水素が化合した固体で、酸化ランタンと水素化ランタンを混合、加熱することで合成される。陰イオンを高速に伝導できる構造を有し、イオン伝導性に優れている。
[用語3] イオン/電子伝導 : 固体や液体中においてイオンもしくは電子が電気を流す現象。金属を流れる電気は主に電子によって輸送されるが、イオン伝導体では、イオンが電気を輸送する。電気の伝導のしやすさは電気伝導度によって表され、単位は「Scm−1」(ジーメンスパーセンチメートル)などで示す。
[用語3a] 電子伝導 : [用語3]を参照のこと。
[用語4] プロトン(H+) : 水素原子が電子1個を失ってイオン化した陽イオン。水素陽イオン。一般に「水素イオン」といえばこちらを指す。
[用語5] 固相合成法 : 固体の出発物質から化学反応を起こし、新たな固体を合成する方法。最終生成物には、多結晶材料、単結晶、ガラス、などがある。一般的には粒子状の無機化合物を混合、ペレット化し、高温で一定時間加熱する。
[用語6] 直流分極法 : 試料を挟んだ電極に電圧を加え、電流値と加えた電圧から伝導度を測定する手法。電極には主たる伝導種であるイオンを透過しない電極を用い、イオンの流れを止めることによって、イオン以外の伝導種に起因する電流を測定する。
[用語7] 活性化エネルギー : イオンが拡散する際に、飛び越えなければならないエネルギー障壁。活性化エネルギーが高いほど、拡散が難しくなる。
[用語8] 第一原理計算 : 量子力学に基づいて電子の状態を計算し、物質の構造や性質を調べることができる方法。原理的には物質に含まれる原子の数や種類を指定するだけよく、これまでに多くのソフトウェアが開発され、物理学や化学、材料科学等の分野で広く用いられている。
[用語9] 機械学習ポテンシャル : 第一原理計算等の高精度な計算手法から得た原子間力やエネルギーを教師データとし、それらを機械学習させて作るポテンシャル(荷電粒子が受ける単位電荷あたりの位置エネルギー)。イオンの拡散など、有限温度における大多数の原子の運動をシミュレーションする際に用いられる。
[用語10] 分子動力学シミュレーション : 原子ならびに分子の物理的な動きの時間発展を計算するコンピューターシミュレーション手法。
参考文献
[1] K. Fukui, S. Iimura, T. Tada, S. Fujitsu, M. Sasase, H. Tamatsukuri, T. Honda, K. Ikeda, T. Otomo, and H. Hosono; Characteristic fast H− ion conduction in oxygen-substituted lanthanum hydride; Nat. Commun.10, 2578 (2019).
論文情報
掲載誌 : |
Journal of the American Chemical Society |
論文タイトル : |
Room-temperature fast H– conduction in oxygen-substituted lanthanum hydride |
著者 : |
Keiga Fukui(福井慧賀)1, Soshi Iimura(飯村壮史)1, 2, 3, Albert Iskandarov(イスカンダル・アルベルト)4, Tomofumi Tada(多田朋史)1, 5, Hideo Hosono(細野秀雄)1, 3 (1: 東京工業大学、2: 科学技術振興機構さきがけ、3: 物質・材料研究機構、4: 横浜市立大学、5: 九州大学) |
DOI : |
お問い合わせ先
東京工業大学 元素戦略研究センター
栄誉教授 細野秀雄
E-mail : hosono@mces.titech.ac.jp
Tel : 045-924-5009
物質・材料研究機構
主任研究員 飯村壮史
E-mail : iimura.soshi@nims.go.jp
Tel : 029-860-4433
JST事業に関すること
科学技術振興機構 戦略研究推進部 グリーンイノベーショングループ
嶋林ゆう子
E-mail : presto@jst.go.jp
Tel : 03-3512-3526 / Fax : 03-3222-2066
取材申し込み先
東京工業大学 総務部 広報課
E-mail : media@jim.titech.ac.jp
Tel : 03-5734-2975 / Fax : 03-5734-3661
物質・材料研究機構 経営企画部門 広報室
E-mail : pressrelease@ml.nims.go.jp
Tel : 029-859-2026 / Fax : 029-859-2017
科学技術振興機構 広報課
E-mail : jstkoho@jst.go.jp
Tel : 03-5214-8404 / Fax : 03-5214-8432