東工大ニュース
東工大ニュース
公開日:2022.04.01
東京工業大学 物質理工学院 応用化学系の藤井航平大学院生、永島佑貴助教、田中健教授と、東京大学 大学院薬学系研究科の下川拓己大学院生、金澤純一朗特任助教(当時)、内山真伸教授を中心とした共同研究グループは、異なる3種類の不飽和化合物[用語1]を混ぜるだけで単一の6員環化合物[用語2]を与える究極の[2+2+2]付加環化反応を開発した。
医薬・農薬・機能性材料に用いられる6員環化合物を、簡便に安価に合成する手法の開発は産業的にも高いニーズが持たれているが、有用な反応手法である[2+2+2]付加環化反応は反応制御が難しく、目的物以外のさまざまな化合物が生成してしまうことが課題とされてきた。生成しうる化合物のパターンは統計学的には300種類を越え、望みの分子のみを得る手法の開発が求められてきた。
今回、共同研究グループはカチオン性ロジウム触媒[用語3]を用いて、原料として1分子のエナミド[用語4]と異なる2種類のアルキン[用語5]を1分子ずつ(計3分子)組み合わせることで、統計学的に想定される300種類以上の分子の中からたった1種類の分子のみを合成できる究極の[2+2+2]付加環化反応を開発した。また、密度汎関数法[用語6]を用いた計算化学的シミュレーションにより、その反応メカニズムを解明した。
研究成果は、英国の科学雑誌「Nature Synthesis」の掲載に先立ち、3月29日(日本時間)にオンライン掲載された。
通常の化学反応では2種類の原料分子を反応させることが多く、A+B→C、C+D→E、E+F→Gといったように、最終目的物が得られるまで段階的に反応を進めていくことため、工程が多くなりがちである。そのため、反応過程で無駄なエネルギー消費や廃棄すべき副生成物が発生することが課題とされている。
一方、本研究で取り上げる多成分反応は、3種類以上の原料分子を一度の化学反応で結合させることを狙う反応である(A+B+C→G)。原料分子の組み合わせを変えるだけで、膨大な種類の有機分子を網羅的に合成できるため、医薬・農薬・機能性材料における新規分子の探索において有用な反応である。一般的な3成分反応では、全く異なる原料分子を3種類用いることで、単一の生成物を与える(図1A)。
![図1 [2+2+2]付加環化反応とこれまでの問題点 (A) 一般的な多成分反応では、全く異なる原料分子を用いることで単一生成物が得られる。 (B) [2+2+2]付加環化反応では類似の反応性をもつ不飽和化合物を原料に用いるため、統計学的には300種類以上の分子が生成する。単一の分子を与える究極の[2+2+2]付加環化反応の開発が望まれていた。](/news/img/news-29615-p1.png)
図1. [2+2+2]付加環化反応とこれまでの問題点
(A) 一般的な多成分反応では、全く異なる原料分子を用いることで単一生成物が得られる。
(B) [2+2+2]付加環化反応では類似の反応性をもつ不飽和化合物を原料に用いるため、統計学的には300種類以上の分子が生成する。単一の分子を与える究極の[2+2+2]付加環化反応の開発が望まれていた。
[2+2+2]付加環化反応は、多成分(3成分反応)のひとつであり、2つの炭素原子が不飽和結合した部位を持つ分子が3つ連結することで、6員環化合物(2+2+2=6)を合成できる効率の良い手法である。しかし、「どの分子が」「どの位置で」「どのような立体環境で」結合を形成するかはランダムであり、同一分子同士で反応してしまった副生成物や、位置異性体[用語7]、ジアステレオマー[用語8]、エナンチオマー[用語9]など、統計学的には300種類以上もの生成物が想定される(図1B)。そのため、様々な望まない生成物(副生成物)を与え、単一の生成物を合成することが困難であった。従来の手法では、用いる原料分子の量に差をつけたり、原料分子を長い時間をかけて混合させたり、様々な工夫をすることで副生成物の種類を抑制しなければならなかった。
本研究では、触媒に対して原料分子が決まった方向を向く性質(配位[用語10])に着目して、分子同士が反応する方向や部位を制御することで、生成しうる分子を限定することを考えた。成果として、複雑な工夫や処理を施すことなく、3種類の原料分子を混合するだけで単一の生成物を得る反応の開発に成功した。
本研究グループでは、これまでにカチオン性ロジウム触媒による[2+2+2]付加環化反応事例を報告してきた。その中で、触媒への分子の配位が高い選択性実現のために必要であるという知見を蓄積してきた。本研究では特に、エナミドと呼ばれる不飽和化合物に着目した。エナミド分子は分子中の酸素原子と不飽和結合の2点で触媒へ配位し強固な錯体[用語11]を形成することで、特殊な反応空間を構築できると考えられるため、ランダムな反応が起こりづらく、高い選択性が実現されると考えた。
実験結果として、末端アルキン、電子不足アルキン、エナミドの異なる3種類の分子を原料に用いた [2+2+2]付加環化反応において、含窒素シクロヘキサジエン[用語12]と呼ばれる6員環化合物のみが生成する反応を見出した。実験操作は極めて簡便であり、原料分子を1:1:1で混ぜ、ロジウム触媒の溶液に同時に加えるだけである。また、本反応を応用して、58例の含窒素シクロヘキサジエンの単一合成にそれぞれ成功した(図2)。
![図2 本研究で開発した[2+2+2]付加環化反応 異なる3種の分子を1:1:1で同時に混ぜるだけで含窒素シクロヘキサジエンが得られる。](/news/img/news-29615-p2.png)
図2. 本研究で開発した[2+2+2]付加環化反応
異なる3種の分子を1:1:1で同時に混ぜるだけで含窒素シクロヘキサジエンが得られる。
得られた光学活性[用語13]な含窒素シクロヘキサジエンは、インフルエンザ治療薬であるタミフルの合成中間体やグリオトキシンなど、医薬品や生理活性物質に含まれる重要な分子構造のひとつである。そのため、生成物のさらなる化学変換によって、医薬品の候補化合物となりうる分子を網羅的に合成することを考えた(図3)。その結果、様々な官能基[用語14]を有する6員環化合物誘導体や5箇所が官能基化されたベンゼン環、含酸素3員環や含窒素・酸素4員環へと変換することに成功した。そのため、本反応は医薬・農薬・機能性分子における新規候補化合物の探索において極めて実用的な反応であることが確認できた。
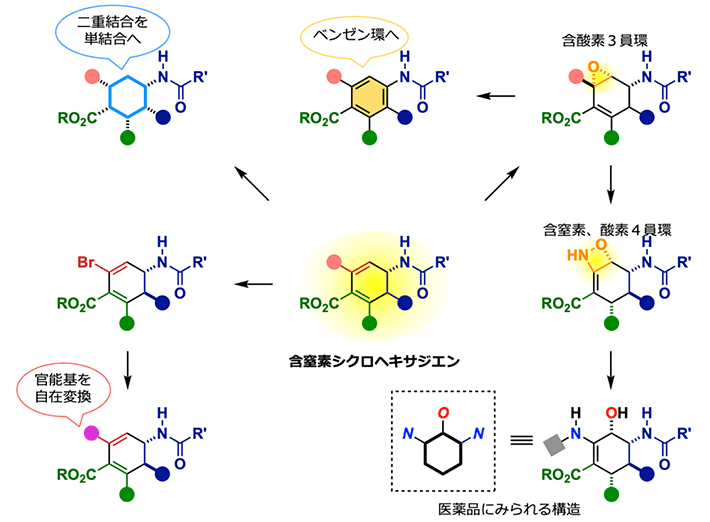
図3. 含窒素シクロヘキサジエンの変換
最後に、開発した[2+2+2]付加環化反応の極めて高い選択性を解明するべく、密度汎関数法と反応経路を自動的に探索するプログラムを組み合わせることで、理論化学的な計算シミュレーションを行った。同手法により、反応中の化学構造・エネルギー推移を網羅的に解析することで、分子が反応する様子をまるでスナップショットを撮るかのように追跡することが可能になる。その結果、本反応では、(1)ロジウム触媒に対してまずエナミドが配位するが反応は起きず、(2)次に残りの2分子が配位し反応を起こし、(3)3分子揃った段階で初めてエナミドも反応に参加する、というメカニズムで進行していることが判明した(図4)。エナミドは、これ以外の順序の配位を全て抑制するとともに、最後に自身が反応に参加することで、単一の生成物を与えており、本触媒系の強力な選択性の秘密が明らかとなった。
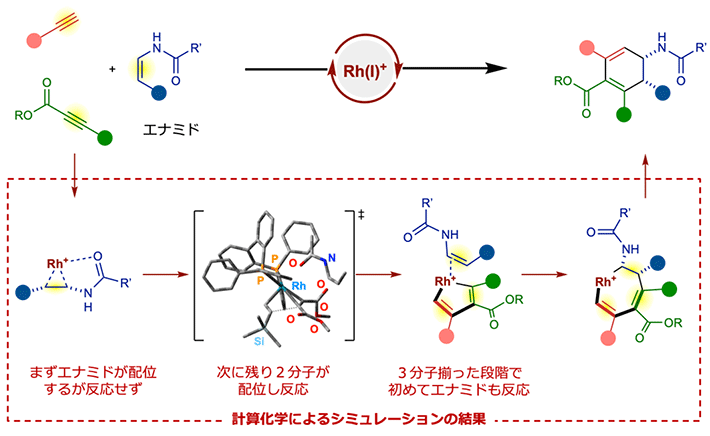
図4. 計算化学による反応メカニズムの解析
本研究では、カチオン性ロジウム触媒に対するエナミド分子の配位能の高さを生かし、単一の生成物を与える究極の[2+2+2]付加環化反応を開発した。得られた含窒素シクロヘキサジエンからは、多種多様な類縁化合物を合成できることを実証し、医薬・農薬・機能性分子における新規候補化合物の探索において極めて実用的な反応であることを示した。
今後、これらの分野における探索研究の発展に大きく寄与することが期待されるとともに、今回示した触媒設計を指針とすることで、さらなる多様な多成分反応の開発へつながると考えている。
付記
本研究は、日本学術振興会(JSPS)科学研究費補助金(JP17K05745、JP17H06173、JP18H04504、JP19H00893)、国立研究開発法人科学技術振興機構(JST)戦略的創造研究推進事業チーム型研究(CREST)(JPMJCR19R2)の支援を受けて行われた。
用語説明
[用語1] 不飽和化合物 : 構造の一部に、原子同士が2本以上の結合で結合している部位をもつ化合物。このような結合は不飽和結合といい、さらに別の原子と結合することができる。
[用語2] 6員環化合物 : 6つの原子で構成された環をもつ化合物。医薬・農薬・機能性分子の多くは6員環をもっている。
[用語3] カチオン性ロジウム触媒 : 金属元素であるロジウムからなる錯体のうち、錯体全体で正電荷をもち、触媒として機能する。触媒とは、化学反応の反応速度を速めたり、特異的な反応を進行させたりする物質であり、反応の前後で性質が変化せず、その構造を保っている。
[用語4] エナミド : アミド結合(-NCHO-)をもちつつ、窒素原子に炭素―炭素二重結合が結合している化合物。
[用語5] アルキン : 炭素―炭素三重結合をもつ化合物であり、不飽和化合物の一種。炭素―炭素三重結合が炭素鎖の末端にあるものを末端アルキンという。また、電子を引き付ける官能基をもち、炭素―炭素三重結合の電子の量が減少しているものを電子不足アルキンという。
[用語6] 密度汎関数法 : エネルギーなどの物性を電子密度から計算することが可能であるとする密度汎関数理論を用いる計算手法。
[用語7] 位置異性体 : 同じ数、同じ種類の原子からなるが、異なる構造をしている化合物のことを異性体という。その中で、原子同士の結合している位置が異なるもの。
[用語8] ジアステレオマー : 異性体のうち、原子の結合は同じだが、原子の幾何的配置が異なるものを立体異性体という。その中で、エナンチオマーではないもの。
[用語9] エナンチオマー : 立体異性体のうち鏡写しの関係にあり、回転しても重ね合わせることができないもの。このような性質をもつ分子をキラル分子という。医薬・農薬では単一のエナンチオマーを合成することが求められる。
[用語10] 配位 : 原子から金属へ2電子供与することで結合すること。
[用語11] 錯体 : 金属原子に分子やイオンが結合することで生成する化合物。
[用語12] 含窒素シクロヘキサジエン : 6員環化合物のうち、環内に炭素―炭素二重結合を2つもつものをシクロヘキサジエンといい、その6員環に窒素原子が結合しているものを指す。
[用語13] 光学活性 : キラル分子において、一方のエナンチオマーに偏っている状態。または、そのような溶液に偏光を通した際に、偏光面を右または左に回転させる性質。
[用語14] 官能基 : 有機化合物の性質を特徴づける原子団や結合様式。
論文情報
掲載誌 : |
Nature Synthesis |
論文タイトル : |
Stereoselective cyclohexadienylamine synthesis through rhodium-catalyzed [2+2+2]-cyclotrimerization |
著者 : |
Kohei Fujii, Yuki Nagashima, Takumi Shimokawa, Junichiro Kanazawa, Haruki Sugiyama, Koji Masutomi, Hidehiro Uekusa, Masanobu Uchiyama*, and Ken Tanaka* |
DOI : |
お問い合わせ先
東京工業大学 物質理工学院 応用化学系
助教 永島佑貴
E-mail : nagashima.y.ae@m.titech.ac.jp
Tel : 03-5734-3631
東京工業大学 物質理工学院 応用化学系
教授 田中健
E-mail : tanaka.k.cg@m.titech.ac.jp
Tel : 03-5734-2120
東京大学 大学院薬学系研究科
教授 内山真伸
E-mail : uchiyama@mol.f.u-tokyo.ac.jp
Tel : 03-5841-0732
取材申し込み先
東京工業大学 総務部 広報課
E-mail : media@jim.titech.ac.jp
Tel : 03-5734-2975 / Fax : 03-5734-3661
東京大学 大学院薬学系研究科・薬学部 庶務チーム
E-mail : shomu@mol.f.u-toyo.ac.jp
Tel : 03-5841-4702 / Fax : 03-5841-4711