東工大ニュース
東工大ニュース
公開日:2022.03.31
東京工業大学 生命理工学院 生命理工学系のモハメド・マルズーク・ソベー大学院生(博士後期課程3年)と北尾彰朗教授は、がん抑制タンパク質p53とDNAの複合体を安定化するアミノ酸残基の役割をシミュレーションで解明した。
p53は細胞が受けたストレスに応答して活発に働くタンパク質であり、細胞のアポトーシスを誘導して細胞のがん化を防ぐなど、さまざまな役割を果たしている。ヒトのがん細胞の約半数でこのp53にアミノ酸変異が起こっているが、特にDNAのコンセンサス配列[用語1]に結合する部位(DNA結合ドメイン:p53-DBD)に異常をきたしていることが多い。本研究ではスーパーコンピュータで高効率・高精度のシミュレーションを実行できるdPaCS-MD/MSM法[用語2]を用いて、p53-DBDがDNAから解離する過程を可視化し、p53とDNAの結合親和性を定量的に計算することに成功した。さらに、いくつかのアミノ酸残基がDNAとの相互作用を安定化させる仕組みを解明し、p53とDNAの相互作用の阻害が、がん細胞に関係するアミノ酸変異と強く相関することを明らかにした。dPaCS-MD/MSM法はこれまでもタンパク質と低分子の結合親和性を正確に予測できていたが、大きな分子同士の結合親和性も高精度で予測できることが本研究で示された。
本研究成果は、2022年3月2日に科学誌「Journal of Chemical Information and Modeling」にオンライン公開され、同誌3月14日版に掲載された。
体の中には細胞のがん化を抑制する仕組みがあるが、その働きが失われることもがん化に深く関係している。例えば、p53と呼ばれるタンパク質は、異常をきたしている(がん化する可能性が高い)細胞が増えないよう働きかけたり、異常細胞の自己死(アポトーシス)を誘導するなどして、がんの発症を抑制する役割を果たしているが、がん細胞の約半数でp53に変異が起きており、その機能が損なわれていることが知られている。
p53は大きく分けて機能の異なる複数のドメインから構成されている。これまでの研究で、がん細胞のp53における変異の多くがDNAと結合するドメイン(p53-DBD)上に生じていることが明らかとなっている。p53-DBDはDNAのコンセンサス配列のMajor groove(幅の広い溝)とMinor groove(狭い溝)に結合するための部位である(図1)。すなわち、p53-DBDを構成するアミノ酸の変異によってp53-DBDそのものやDNAとの結合が不安定化していることが考えられる。しかしながら、これらのアミノ酸がDNAとの結合においてどのような役割を担っているのかは、まだ十分解明されていなかった。そこで、本研究ではシミュレーション手法を用いて、DNAとの結合に関わるアミノ酸を明らかにすることを目指した。従来のシミュレーション法ではタンパク質やDNAなどの大きな分子同士からなる複合体の解離や結合の過程を可視化することは難しかったが、今回はスーパーコンピュータの能力を最大限活用する計算手法を採用することも試みた。
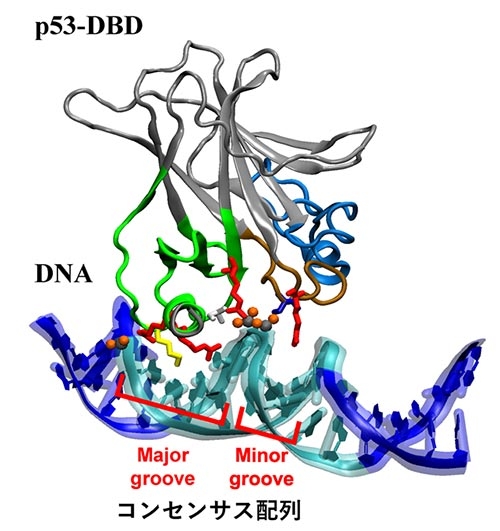
図1. p53-DBDとDNAの結合構造。
p53-DBDはコンセンサス配列(水色の部位)にあるMajor grooveとMinor grooveでDNAを認識している。コンセンサス配列の認識に重要なアミノ酸(赤、黄)も示した。
本研究においてソベー大学院生と北尾教授は、特にDNAとp53-DBDの解離過程のシミュレーションを行い、解離過程を明らかにすることで、DNAとp53-DBDをつなぎ止めようとするアミノ酸(すなわち結合にも重要な役割を持つアミノ酸)についての知見が得られると考えた。成果として、スーパーコンピュータの計算能力を高い効率で利用できる超並列計算法であるdPaCS-MDを用いて、p53がDNAから解離する過程のシミュレーションに初めて成功した(図2)。p53-DBDの解離はDNAから見て様々な方向に起こるが、詳しく見ると2つの解離経路に分類できることが分かった。ほとんどの場合に、p53-DBDはまずMajor grooveからが離れ、そのあとでMinor grooveから外れることで解離が完成する(主な経路)。しかし、稀に最初にMinor grooveから離れ、最後にMajor grooveから解離することもある(稀な経路)。

図2. シミュレーションによって明らかとなった、p53-DBDのDNAからの解離経路。
P53-DBDの重心位置の移動過程を可視化したところ、様々な方向に解離していることがわかった。解離経路の色の違いは解離前の複合体構造の違いを表している。
この理由を詳しく調べるためMSMを用いて、解離に伴う自由エネルギー変化を調べた(図3)。主な経路では大きなエネルギー障壁がないので解離が起こりやすいが、稀な経路では解離の初期過程に大きなエネルギー障壁があるため解離が起こりにくいことが分かった。このエネルギー障壁の要因として、p53-DBDの1つのアルギニン側鎖がMinor grooveと深く結合しており、解離しづらいことが挙げられる。この事実は、このアルギニン残基がp53-DBDのDNA認識や結合安定化において重要な役割を持っていることを強く示唆している。このアミノ残基の変異は、がん細胞で見つかる変異の中でもっとも頻度が高いものの1つであり、変異によってp53とDNAが結合しづらくなることが、がん化を防ぐ機能の損失につながっていると考えられる。さらにdPaCS-MD/MSM法を用いて、p53-DBDとDNAの結合の強さを示す標準結合自由エネルギーを計算したところ、得られた値は実験値とよく一致していた。従来法ではDNAとタンパク質などの大きな分子同士の結合自由エネルギーを計算することは難しかった。これまでの結果でもdPaCS-MD/MSM法による結合自由エネルギーの計算精度は高いので、この方法は様々な分子複合体の結合自由エネルギーを比較的少ない計算量で正確に計算できることが実証された。
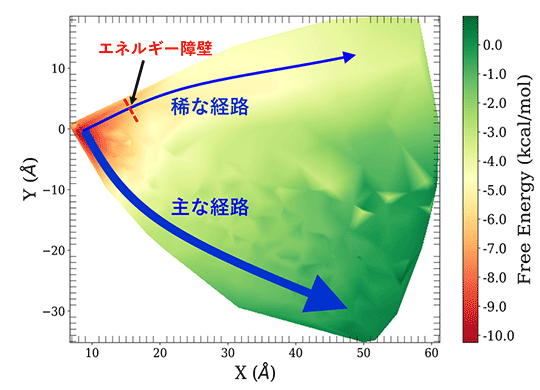
図3. p53-DBDの解離に伴う結合自由エネルギー変化。
主な経路ではエネルギー変化は急激だがエネルギー障壁がなく解離が起こりやすい。稀な経路では解離に伴う大きなエネルギー障壁があり、解離が起こりにくい。
今後は様々なp53-DBDのアミノ酸変異体で同様なシミュレーションを行うことで、個々の変異の影響を調べることを計画している。またp53-DBDそのものやDNAとの相互作用を安定化する化合物を探索することで、p53の機能を回復させる薬の可能性も検討するとともに、dPaCS-MD/MSM法を用いて様々な分子複合体の親和性の定量的な予測を行っていく予定である。
用語説明
[用語1] コンセンサス配列 : p53が認識して結合する特定のDNA配列のこと。
[用語2] dPaCS-MD/MSM法 : dPaCS-MD(解離型並列カスケード選択分子動力学)とMSM(マルコフ状態モデル)を組み合わせた計算法。分子動力学は、タンパク質・核酸・水・イオンなどからなるシステムが時間に沿って変化していく様子を原子レベルのモデルを使ってコンピュータ上でシミュレーションする方法である。PaCS-MDは、多数の独立な分子動力学を並列で短時間実行し、得られた構造の中から観察したい現象に近い構造を複数選択し、それらを出発構造として分子動力学を再実行するサイクルを繰り返すことで、実時間より数桁短いシミュレーション時間で重要な現象を観察できる。dPaCS-MDは解離を観察するPaCS-MDである。MSMは多数の分子動力学で得られた結果を統合して状態の確率や自由エネルギーを計算できる。dPaCS-MD/MSM法は分子複合体の解離経路や結合親和性(結合自由エネルギー、解離速度定数など)を高精度に予測できる。
論文情報
掲載誌 : |
Journal of Chemical Information and Modeling |
論文タイトル : |
Dissociation Pathways of the p53 DNA Binding Domain from DNA and Critical Roles of Key Residues Elucidated by dPaCS-MD/MSM |
著者 : |
Mohamed Marzouk Sobeh, Akio Kitao |
DOI : |
お問い合わせ先
東京工業大学 生命理工学院 生命理工学系
教授 北尾彰朗
E-mail : akitao@bio.titech.ac.jp
Tel : 03-5734-3373 / Fax : 03-5734-3372
取材申し込み先
東京工業大学 総務部 広報課
E-mail : media@jim.titech.ac.jp
Tel : 03-5734-2975 / Fax : 03-5734-3661