東工大ニュース
東工大ニュース
公開日:2023.01.23
東京工業大学 科学技術創成研究院の茶谷悠平特任助教、丹羽達也助教、田口英樹教授、同大学 生命理工学院の伊藤遥介大学院生(研究当時)、山川絢子大学院生、兵庫県立大学 大学院工学研究科の今高寛晃教授、町田幸大准教授らのグループは、遺伝情報をもとにさまざまなタンパク質を合成する「翻訳」の際、負電荷アミノ酸に富んだアミノ酸配列の翻訳時には、翻訳の連続性が破綻してしまう「リボソーム[用語1]の不安定化」現象が、原核生物だけでなく出芽酵母をはじめとした真核生物でも発生していることを明らかにした。
細胞内装置であるリボソームは、DNAからメッセンジャーRNA(mRNA)に転写された遺伝情報をもとにさまざまなタンパク質を合成する(生命のセントラルドグマ[用語2]における「翻訳」過程)。その際、タンパク質の設計図であるmRNAを最初(開始コドン)から最後(終止コドン)まで連続的に読み取る必要があり、読み取りが途中で中断すると設計図通りのタンパク質を生み出せなくなってしまう。本研究グループは以前に、原核生物において、負電荷アミノ酸に富んだアミノ酸配列の合成過程で「リボソームの不安定化」現象が起こって翻訳の途中中断のリスクがあることを見出していたが、本研究によって、出芽酵母やヒトなどのタンパク質合成過程でも、合成産物による翻訳の途中終了が発生していることを明らかにした。また、途中終了のリスクが高まる翻訳開始直後では特定のアミノ酸の使用を避ける傾向が大腸菌からヒトに至るまで幅広い生物で見出された。このことは、「リボソームの不安定化」現象が合成装置リボソームを利用する地球生命の遺伝子発現の基本原則の一つとなっている可能性を示唆している。
本研究成果は、欧州Nature Portfolioが発行する総合誌「Nature Communications」のオンライン速報版で2022年12月2日に公開された。
多様な細胞機能の根幹を司る重要な生命分子であるタンパク質は、細胞内装置であるリボソームが、DNAからmRNAへと写しとられた遺伝情報を元に、アミノ酸配列へと変換(「翻訳」と呼ぶ)することで合成される。合成途上にある新生タンパク質(新生ポリペプチド鎖、これを新生鎖と呼ぶ)は、リボソームの大サブユニットを貫通する「トンネル」を通過しながら伸長していく。近年、この「トンネル」内の新生鎖は、そのアミノ酸配列の並びなどによって多様にリボソームの機能を制御しうることが分かってきている。例えば、本研究グループは過去に、バクテリア(大腸菌)を用いた実験から負電荷アミノ酸(アスパラギン酸とグルタミン酸)に富む新生鎖を合成する途上で翻訳が破綻する現象(Intrinsic Ribosome Destabilization:内因性リボソーム不安定化現象、IRDと命名)を発見し、その生物学的な意義も含めて報告した。一方、他の生物種でIRDが発生するかは不明であった。
今回本研究グループは、出芽酵母、ヒト培養細胞由来の再構成型無細胞翻訳系(ヒトPUREシステム)を用いた解析から、真核生物においてもIRDが発生することを実証した。具体的には、アスパラギン酸(略号でD)やグルタミン酸(略号でE)からなる負電荷(酸性)アミノ酸が多く含まれるアミノ酸配列を翻訳しているリボソームが、翻訳途上でさらなる翻訳伸長を止めて、一部が翻訳中断することを見出した(図1)。また、出芽酵母での遺伝学的解析から、ペプチジルtRNA分解酵素の一つ(Pth2)が、不安定化したリボソーム中の合成途上産物を分解していることが明らかになった。さらに、Pth2欠損株では、IRDによって翻訳が途中終結した産物が多数蓄積していることを質量分析装置による解析から明らかにした。
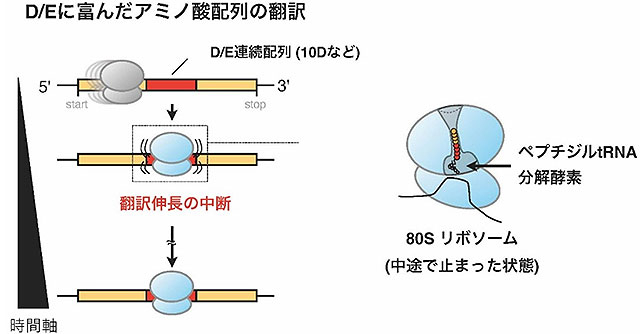
加えて、本研究グループは、IRDのリスクが増大する翻訳初期段階では、負電荷アミノ酸に富む配列の翻訳を避けるよう遺伝子配列に一定の制約がかかっていることもデータ解析から明らかにした(図2)。この結果は、IRDが生物に共通の普遍的な現象であることを示唆している。
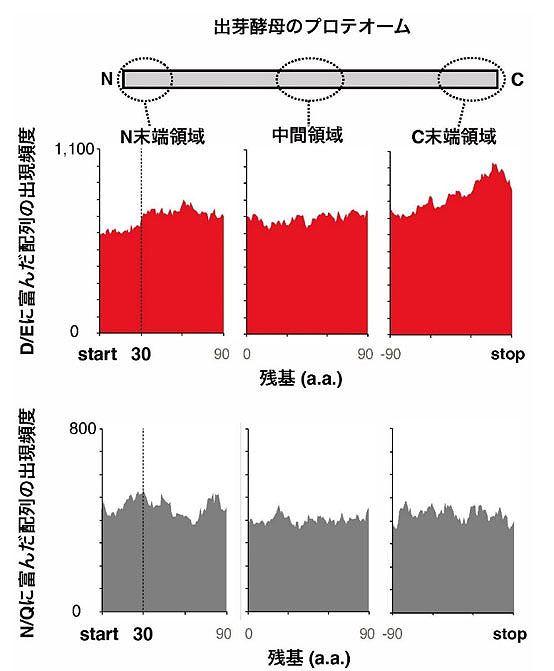
生命活動をつかさどるタンパク質は全てリボソームで合成されるので、リボソームがどのようなアミノ酸配列からでもタンパク質を合成できるということが細胞内タンパク質全体(プロテオーム)を支える前提である。したがって、本研究によってリボソームには「苦手な」アミノ酸配列があることがさまざまな生物で共通であるというのは意外な発見である。つまり、本発見は、生命のセントラルドグマの中のタンパク質合成ステップ(翻訳反応)における基礎的な新事実であると言える。
応用的な側面からは、創薬や産業利用で有用なタンパク質を生産する際に本研究による知見を応用することができる。例えば、これまで細胞内で大量に合成することが難しかったタンパク質を安定的に、かつ、過剰に作らせることが可能になると期待される。
今回の研究から、原核生物に限定的と考えられていたIRDが広く生物で発生していることが示唆された。IRDを起こしやすい負電荷アミノ酸に富む配列は大腸菌からヒトに至るまでの遺伝子に幅広く存在することから、今後IRD、あるいはそれに関連した遺伝子発現制御はさまざまな生命現象に発展、波及していく可能性が浮上してきた。すなわち、IRDは新たな翻訳終結シグナルとしての遺伝暗号として、「遺伝子」を再定義する新概念ともなりうる可能性を秘めている。
付記
本研究は、文部科学省科学研究費助成事業(田口英樹:JP26116002、JP18H03984、JP20H05925、茶谷悠平:17K15062、19K16038)、大隅基礎科学創成財団(茶谷悠平)等の支援を受けて行われた。
用語説明
[用語1] リボソーム : RNAとタンパク質からなる巨大な複合体でタンパク質の合成装置。リボソームはメッセンジャーRNAの塩基配列を読み取って、遺伝子に書き込まれている遺伝暗号に従って20種類のアミノ酸を選び、特定の順番につなげていくことにより、タンパク質の鎖(ポリペプチド鎖)を合成する。
[用語2] 生命のセントラルドグマ : DNA→RNA→タンパク質という情報の流れと変換を記述した分子生物学の根幹をなす概念のこと。大きくは、DNAの塩基配列の情報がメッセンジャーRNAに写される「転写」と、メッセンジャーRNA、トランスファーRNA、およびリボソームなどの共同作用でタンパク質を合成する「翻訳」に分かれる。
論文情報
掲載誌 : |
Nature Communications |
論文タイトル : |
Nascent peptide-induced translation discontinuation in eukaryotes impacts biased amino acid usage in proteomes(和訳:真核生物における新生ポリペプチド鎖による翻訳の途中終了は、プロテオームのアミノ酸使用頻度にバイアスを与える) |
著者 : |
Yosuke Ito, Yuhei Chadani, Tatsuya Niwa, Ayako Yamakawa, Kodai Machida, Hiroaki Imataka, and Hideki Taguchi |
DOI : |
お問い合わせ先
東京工業大学 科学技術創成研究院 細胞制御工学研究センター
教授 田口英樹
Email taguchi@bio.titech.ac.jp
Tel / Fax 045-924-5785
兵庫県立大学大学院 工学研究科 応用化学専攻
教授 今高寛晃
Email imataka@eng.u-hyogo.ac.jp
Tel 079-267-4021 / Fax 079-267-4885
取材申し込み先
東京工業大学 総務部 広報課
Email media@jim.titech.ac.jp
Tel 03-5734-2975 / Fax 03-5734-3661
兵庫県立大学姫路工学キャンパス経営部 総務課
Email soumu_kougaku@ofc.u-hyogo.ac.jp
Tel 079-266-1661 / Fax 079-266-8868