東工大ニュース
東工大ニュース
公開日:2023.02.17
東京工業大学 生命理工学院 生命理工学系の秋山健太郎大学院生(日本学術振興会特別研究員)と同 科学技術創成研究院 化学生命科学研究所の久堀徹教授、若林憲一准教授らは、岡山大学の高橋裕一郎教授(特任)、小澤真一郎助教(特任)らと共同で、植物の光合成反応でATP[用語1]合成を担っている葉緑体ATP合成酵素の機能制御スイッチ部分を遺伝子組み換えによって改変することで、酵素活性の制御のしくみを分子レベルで明らかにした。
光合成を行う葉緑体内の酵素は、自然界で変化する光環境に応じてその活性を調節し、代謝機能を切り替えるのに不可欠な「酸化還元スイッチ」を備えている。中でも、分子モーターとして知られる葉緑体ATP合成酵素は、回転軸になるタンパク質部分に制御スイッチを持っており、このスイッチが回転を制御するしくみは以前から注目されてきた。
研究グループは、この葉緑体ATP合成酵素の制御スイッチのしくみを調べるため、遺伝子改変が容易な緑藻クラミドモナスを用い、遺伝子組み換えによって制御スイッチ部分のさまざまな構造変異体を作出した。具体的には、制御スイッチを構成するアミノ酸配列の部分的な切除・置換を行い、スイッチの動作の詳細を調べた。これまでの研究での構造解析から、このスイッチは大きく2つの構造単位(ドメイン)で構成されていることがわかっていたが、今回の研究により、この2つのドメインがそれぞれ果たす役割と、それによって酵素の活性、すなわち分子モーターの回転を制御するしくみが明らかになった。
この酵素の活性制御の研究では、これまで部分複合体を用いてATP加水分解時の活性変化が調べられていたが、今回の研究では初めて完全な酵素複合体を用いて、ATP合成活性そのものが酸化還元スイッチによって制御されていることを明らかにした。
本研究成果は1月30日付け「Proceedings of National Academy of Science USA」電子版に発表された。
植物の光合成は、光エネルギーを用いて二酸化炭素と水から糖分子を生産する、地球規模の壮大なエネルギー変換反応である。細胞内で光合成を行う葉緑体の内部には、チラコイド膜という生体膜の層が発達しており、この膜構造がストロマというゾル部分に囲まれている。チラコイド膜には複数の膜タンパク質複合体が埋め込まれており、光合成電子伝達系[用語2]を構成している。この複合体間で電子を連続して受け渡すことで、クロロフィル分子が捕獲した光エネルギーを化学エネルギー(ATPとNADPH[用語3])に変換する。さらにこのATPとNADPHが、ストロマに存在する酵素群によって、糖分子を合成する化学反応に用いられる。
この一連の光合成の反応過程は、光条件が整った時に、円滑かつ最適な状態で行われるように精密に制御されている。この制御を担うのが酸化還元制御系[用語4]である。光合成電子伝達系が駆動すると、水の分解によって還元物質であるNADPHが生産されるが、この時に生じる還元力の一部がタンパク質の還元にも用いられる。糖分子の合成反応を担う酵素群は、酵素分子自身が還元されると酵素活性が発現する、光合成条件下でのみはたらく分子スイッチを持っている。その実体は1組のシステインペアで、これが酸化されると酵素は不活性化型(眠っている状態)、還元されると活性型になる。
ATP合成酵素は、ヒト細胞内のミトコンドリアでの呼吸反応や、葉緑体の光合成反応でATPを合成する重要な酵素で、その構造は多くの生物で共通である。酵素分子複合体自体は回転分子モーターの構造をしており、中央の回転軸のサブユニットが回転すると酵素上で反応が進行する。興味深いことに、葉緑体ATP合成酵素は他の生物由来のものと異なり、回転軸のサブユニットに1組のシステインペアを持ち、その酸化還元によって回転そのものが制御を受けるしくみになっている(図1)。しかし、軸部分の酸化還元スイッチが回転を制御する具体的なしくみは、これまで大きな謎だった。

図1. ATP合成酵素の回転軸を構成するγサブユニットのアミノ酸配列の比較
この酵素の研究が進まなかった理由のひとつは、研究材料にあった。ATP合成酵素は葉緑体から大量に単離精製できるが、これまで主に用いられてきたホウレンソウでは分子生物学的なアプローチに制約があった。また近年、植物の光合成研究に一般的に用いられているシロイヌナズナは植物個体が小さいため、生化学的な取り扱いが可能な量の酵素を迅速に調製するのには向かない。研究グループはこの制約を突破するため、分子生物学的手法を駆使してさまざまな研究が既に行われている単細胞緑藻クラミドモナスを用いた。
研究グループは、クラミドモナスから葉緑体ATP合成酵素を簡便かつ高純度に精製するため、膜から突出しているβサブユニットの先端にHisタグ[用語5]というアミノ酸配列を導入した。こうすることで、酵素はNi-NTAカラム[用語5]を用いた親和性クロマトグラフィによって簡単に精製できる。
葉緑体ATP合成酵素のγサブユニットは、光合成生物特有の付加的な配列を持っている。(図1、図2左)。これまでの結晶構造解析やクライオ電子顕微鏡による構造解析によって、その付加的な配列は触媒サブユニットと相互作用できるところまで立ち上がっているドメイン(β-hairpinドメイン[用語6])と、酸化還元応答するCysペアを含むドメイン(Redox loopドメイン[用語7])という2つのドメインで構成されていることが既に知られている。そこで研究グループは、この2つのドメインのどちらか一方を削った変異酵素(ΔRedox_loopとΔβ-hairpin)と両方を削った変異酵素(ΔInsertion)を作出した(図2右)。また、レドックス制御に重要な役割を果たしているという報告がある、負電荷アミノ酸に富んだモチーフ(DDEモチーフ[用語8])を、全て中性アミノ酸に置換した変異酵素(DDE/NNQ)も作出した。こうした変異体の酵素機能を生化学的に調べることで、2つのドメインそれぞれの役割を明らかにすることを目指した。
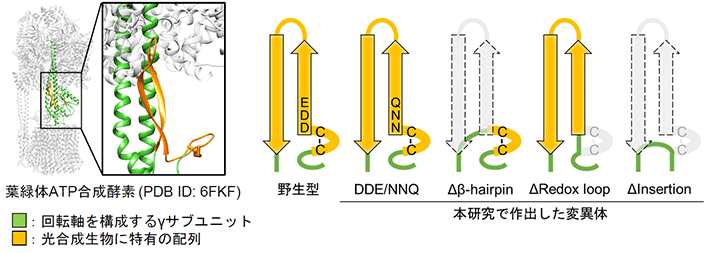
図2. 光合成生物のγサブユニットに特有の配列の構造と本研究で作出した変異体のモデル図
DDE/NNQのATP合成活性は野生型と同様に酸化還元応答を示したことから、DDEモチーフの電荷は酸化還元制御には必須でないことがわかった。一方、Δβ-hairpinは酸化還元状態によらず十分なATP合成活性を示した。つまり、redox loopドメイン上のCysペアだけでは活性を制御することができないことになる。また、ΔRedox_loopの活性が酸化状態の野生型と同程度に低かったのに対して、ΔInsertionの活性ははるかに高かった。このことから、β-hairpinドメインがATP合成方向に対して負の活性制御因子となっていると考えることができる。以上の結果をまとめると図3のようになる。
このように、酸化還元制御スイッチを構成する2つのドメインそれぞれの役割を明らかにできた。この結果は、ATP合成酵素がこのスイッチによってどのように制御されるのかについての、新たなモデルを提案するものである。
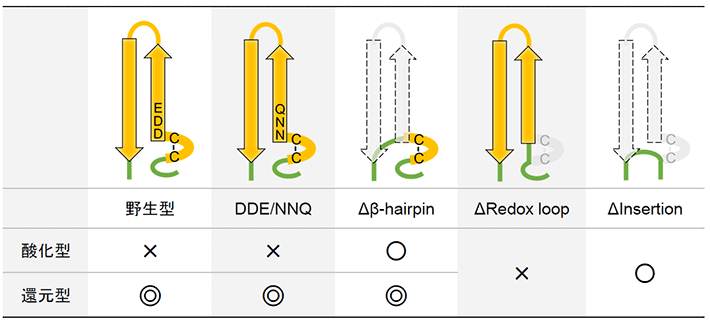
図3. それぞれ酸化還元状態における酵素のATP合成活性と変異の関係
光合成における葉緑体ATP合成酵素のはたらきは、全ての酵素が持つ触媒反応の性質上、基本的には逆反応が可能である。そのため、光エネルギーが供給されない暗所では、生成したATPが分解される。植物はそうした生存に不利な反応を抑えるために、光合成反応を担う酵素群に酸化還元スイッチという巧妙なしくみを用意し、暗所では酵素を不活性化させている。そうしたATP合成酵素の酸化還元スイッチのしくみを分子レベルで明らかにした今回の成果は、緑色植物が行う光合成についての本質的な理解を進めるものである。植物は、光合成で生成した糖を食糧として供給することで、私たち人間の生命を支えている。そのため、今回の成果のような光合成についての基本的な知見は、長期的にみて社会全体に大きく資するといえる。
ATP合成酵素は、1997年に自然界で最小の分子モーターであることが東京工業大学の研究者によって明らかにされたユニークな酵素である。その回転の制御のしくみは長年謎だったが、今回の研究によって25年越しで明らかになったことになる。工学的な面でみると、一方向の回転の制御といえば、自転車のギアに使われているラチェットがよく知られている。モータータンパク質の回転制御がラチェットと同じような部品で行われているとしたら、とても興味深い偶然の一致だといえる。
この研究は、単細胞緑藻クラミドモナスが持つ、遺伝子改変が容易であるという分子生物学的な強みを活かすことで実現した。この研究により、これまで不明だった、葉緑体ATP合成酵素の酸化還元制御スイッチの重要な機能部位を明らかにすることができた。残された課題は、スイッチがはたらく時に実際にどのような構造変化や、周辺のアミノ酸との相互作用をすることで、軸の回転や触媒活性を制御しているのかという点である。実際に回転軸がラチェットのようにはたらく様子が観察できたら面白いだろう。さらに今回の研究は、制御スイッチ部分のアミノ酸配列を自在に書き換えて、酵素を簡便に得る方法を確立できたという点で、構造生物学的な研究の進展にも貢献できるものだといえる。
付記
本研究は、科学研究費助成事業 基盤研究(B)(21H02502 代表:久堀徹教授)、挑戦的研究(萌芽)(21K19210 代表:久堀徹教授)、基盤研究(B)(22H02642 代表:若林憲一准教授)、基盤研究(C)(21K06217 代表:岡山大学・小澤真一郎)および日本学術振興会特別研究員奨励費(20J22917 秋山健太郎)の支援を受けて行われた。
用語説明
[用語1] ATP : ATP(adenosine triphosphate)は全ての生物がエネルギー化合物として利用している。アデノシンという化合物にリン酸基が3個直列に結合した構造をしていて、2番目と3番目のリン酸基の間の無水結合が開裂したときに大きなエネルギーを放出する。このエネルギーを共役させることで、生体内で反応にエネルギーを必要とする反応は進行している。
[用語2] 光合成電子伝達系 : 葉緑体チラコイド膜に局在し、水を分解し酸素発生と電子の生成を行う光化学系II、NADP+の還元を行う光化学系I、および、この両者をつなぐ電子伝達タンパク質であるシトクロムb6f複合体、という3つの主要なタンパク質複合体で構成されている。この三者のはたらきによって、水が分解されて酸素が発生し、還元物質であるNADPHを生成する。この反応の過程で、チラコイド膜のストロマ側からルーメン側(内腔側)にプロトンが輸送され、これによってチラコイド膜の内外にプロトンの電気化学ポテンシャル差(簡単に言えばプロトンの濃度勾配と膜電位の差の合計)が形成される。これを葉緑体ATP合成酵素が利用して、エネルギー物質であるATPが生産される。
[用語3] NADPH : ニコチンアミドアデニンジヌクレオチドリン酸(NADP)の還元型。他の分子と電子のやり取りをすることで、酸化型のNADP+と還元型NADPHの間で相互変換する。光合成生物では、NADPHは炭素固定反応の還元力供給源となる。
[用語4] 酸化還元制御系 : 酸化還元状態に応じて、タンパク質分子の持っているジスルフィド結合の形成解離を制御することにより、そのタンパク質の酵素活性を調節する分子機構。タンパク質の翻訳後修飾のひとつ。
[用語5] Hisタグ、Ni-NTAカラム : タンパク質を構成するアミノ酸のうち、His(ヒスチジン)は側鎖にイミダゾイル基という複素芳香環(五角形で窒素原子2つを含む)を持っている。これを複数連ねると、Hisの窒素原子が持つ孤立電子対がNiイオンに特異的に配位して結合する。このため、タンパク質側にHisの鎖(Hisを5~10個連ねたペプチド)を付加しておくと、そのタンパク質がNiをキレートした担体(Ni-NTA)に特異的に捕捉される。この性質を利用して親和性クロマトグラフィでタンパク質を簡単に精製することができる。
[用語6] β-hairpinドメイン : タンパク質を構成するアミノ酸は、その配列の組み合わせによってさまざまな立体構造を形成する。アミノ酸のつながったペプチドがある場所で180度折り返すような構造をこのように呼ぶ。また、アミノ酸の鎖がある程度の長さで特定の構造を取っている部分をドメインと呼ぶ。葉緑体ATP合成酵素 γサブユニットのβ-hairpinドメインは、触媒サブユニットと相互作用できるところまで立ち上がっている。
[用語7] Redox loopドメイン : 葉緑体ATP合成酵素の回転軸を構成するγサブユニットには酸化還元応答するCysペアが局在している場所があり、この部分が特定の二次構造を取らずにループ状に存在するので、このように呼ぶ。
[用語8] DDEモチーフ : アミノ酸の一文字表記でDはアスパラギン酸、Eはグルタミン酸を表す。これらのアミノ酸は側鎖にカルボキシ基を持ち、中性条件では負電荷を帯びるため、負電荷アミノ酸と呼ばれる。また、一文字表記のNはアスパラギン、Qはグルタミンを表し、それぞれ側鎖のカルボキシ基上のヒドロキシ基がアミノ基に置換されているため、電離していない。そのため、これらのアミノ酸は中性アミノ酸と呼ばれる。このようにある種のアミノ酸が集合して特定の機能を持っている部分をモチーフと呼ぶ。
論文情報
掲載誌 : |
Proceedings of National Academy of Science USA |
論文タイトル : |
Two specific domains of the γ subunit of chloroplast FoF1 provide redox regulation of the ATP synthesis through conformational changes |
著者 : |
Kentaro Akiyama, Shin-Ichiro Ozawa, Yuichiro Takahashi, Keisuke Yoshida, Toshiharu Suzuki, Kumiko Kondo, Ken-ichi Wakabayashi, and Toru Hisabori |
DOI : |
お問い合わせ先
東京工業大学 科学技術創成研究院 化学生命科学研究所
教授 久堀徹
Email thisabor@res.titech.ac.jp
Tel 045-924-5234 / Fax 045-924-5268
取材申し込み先
東京工業大学 総務部 広報課
Email media@jim.titech.ac.jp
Tel 03-5734-2975 / Fax 03-5734-3661
岡山大学総務・企画部広報課