ノーベル賞レポート
ノーベル賞レポート

2016年12月7日
カロリンスカ研究所
アーラ・メディカホールにて
皆様、ノーベル生理学・医学賞の受賞者としてここにお招きいただき、大変光栄に思います。まず、このすばらしい機会を与えてくださったカロリンスカ研究所とノーベル財団に心より感謝を申し上げます。また、本日ご出席の皆様全員にお礼を申し上げます。
では始めましょう。
科学とは、社会によって徐々に積み重ねられた知識の体系ですが、人間の本質的な活動でもあります。私は、すべての科学者は、それぞれの生きている時代の産物だと考えます。ですから本日は、私のこれまでの人生を簡単に紹介した上で、研究概要を歴史的にご説明いたします。


ノーベルレクチャースタート
私は、第二次世界大戦が終わる半年前の1945年、九州の福岡で生まれました。日本にとっては非常に厳しい時期であり、誰もが、食料をはじめ生活必需品の入手に苦労していました。私もひどい栄養失調で、病気ばかりしている子供でした。当時、母が結核を患い、長い間、床に就いていましたが、ハワイに住んでいる知人が、開発されたばかりの抗生物質を贈ってくれたおかげで、奇跡的に回復しました。ストレプトマイシン、オーレオマイシンという言葉は、よく理解できないながらも幼心に残りました。
子供時代を過ごした家は自然に囲まれ、田んぼ、小川、山、海のすべてが身近にありました。外で魚を捕まえたり、植物を摘んだりして長い時間を過ごしたように思います。小学校の頃は、虫捕りと星空を眺めることに夢中でした。この自然に対する親近感が、私の人生を決めたと言えるでしょう。漠然と科学者をめざすようになったのは、この頃です。
高校では化学部に入り、化学反応の不思議に心を打たれました。東京大学に入学した当初も、化学者になろうと思っていました。しかし、研究者としての進路がなかなか決まりません。折しも、セントラルドグマが確立されました。私は即座に分子生物学に魅了され、大学院生として今堀和友先生の研究室に入りました。ここで、研究者として初めて手がけたのが、タンパク質の合成装置であるリボソームです。この頃から、細胞内におけるタンパク質合成の連続的な性質を強く意識するようになりました。やがて、生体膜の未知の機能に興味を持つようになり、コリシンE3の機作を研究しました。これは、他の細胞の、膜の受容体と結合することにより、タンパク質の合成を妨げる毒素タンパク質です。
博士研究を終えた後は、ニューヨークにあるロックフェラー大に留学し、ジェラルド・エーデルマン博士の研究室に入りました。この研究室で最後の年、マイク・ジャズウィンスキーさんと一緒に、酵母におけるDNA複製の開始機構を研究しました。これが、実験生物としての酵母との出会いでした。
 スライド3枚目
スライド3枚目
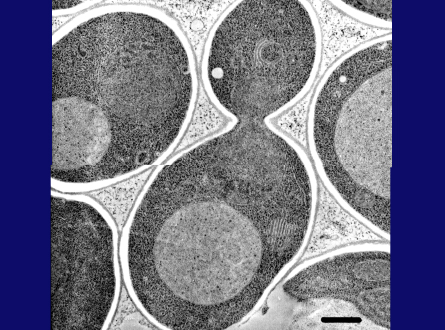
1977年、私は日本に戻り、東京大学の安楽泰宏教授の、研究室の助手に着任しました。この研究室は全体として、大腸菌におけるトランスポーターと呼吸鎖に取り組んでいましたが、教授は私が酵母の研究を始めることを許してくださいました。しばらく検討した後、私は酵母の液胞を研究することにしました。人と競争するよりも、あまり人のやらないテーマが好きだったからです。これ(スライド3枚目)は、酵母の液胞の電子顕微鏡写真です。液胞は比較的大きいのですが、内部に明確な構造はありません。当時、液胞は細胞内の「ごみ溜め」と思われていましたが、私は、液胞に細胞生理学上の未知の役割があるに違いないと思いました。そして、液胞膜を通じたアミノ酸とカルシウムイオンの能動輸送を示し、液胞が代謝物質とイオンの恒常性維持に重要であることを立証しました。また、液胞膜に存在する新しいプロトンポンプ「V-ATPase」が液胞膜内外でプロトン勾配を形成していることを解明しました。
1988年には、東京大学教養学部に独立した研究室を持つことができました。メンバーは私だけでしたが、ここで酵母の液胞の、分解機能の研究に集中することにしました。液胞は酸性コンパートメントであり、各種の加水分解酵素を含むため、私は液胞とリソソームが相同かもしれないと考えました。しかし、この問題にどう取り組むか、具体的なアイデアはありませんでした。
スライド7枚目
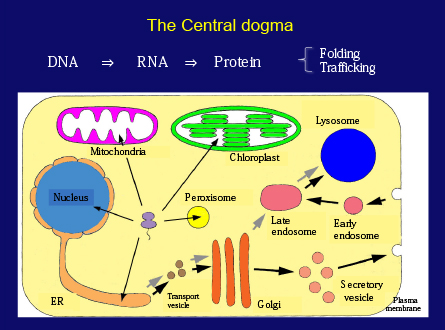
実験の詳細を説明する前に、細胞のタンパク質代謝について少し触れておきましょう。アミノ酸のポリマーであるタンパク質は、すべての生物学的プロセスに重要な役割を果たします。セントラルドグマによれば、タンパク質はDNAに符号化されている一般的情報に基づいてRNAを介して合成されます。このため多くの研究者が、遺伝子発現とタンパク質合成を理解しようと努力してきました。細胞生物学の近年の進歩により、それぞれのタンパク質は細胞内の特定の目的地に移動することがわかりました。今では、各タンパク質が、細胞内輸送のプロセスによって巧妙に整理されていることがわかっています。
しかしここ(スライド7枚目)には、細胞内のタンパク質の分解という観点が欠けています。私はかつて大学1年生に対する最初の生物学の授業で、「人間の体内で1秒間に赤血球が何個作られるか?」と質問していました。計算は簡単で、答えは約300万個になります。赤血球内のヘモグロビンはどうでしょう?さらに計算すると、1秒間に合成されるヘモグロビン分子は約1×1015個、つまり1,000兆個になります。つまり、まったく同じ量の細胞とタンパク質が分解されているということです。生物は、これほどダイナミックに維持されているのです。
日本の気候の特徴である四季は文化に影響を与えています。学校ではすべてが常に変化していると教えられます。典型的な例が樹木の葉です。春には成長し、日光を浴びてせっせとでんぷんを合成しますが、秋には紅葉し、地面に落ちます。美しい秋の紅葉は、実は光合成装置の分解によって生じています。緑色の葉緑体は完全に分解され、その結果として生じるアミノ酸が幹に輸送されます。同様に、稲の葉も収穫期には黄色になります。葉の中のタンパク質はすべて分解され、輸送されて、次世代のために米粒の中でタンパク質を作ります。これらの例は、分解が不利益なプロセスではなく、むしろ新たな構築や再生に必須の過程であることを示しています。人体について考えましょう。人間の体は毎日約200~300gのタンパク質を作っていますが、食事では約70~80gしか摂取していません。タンパク質の合成に必要なアミノ酸のほとんどは、体内のタンパク質の分解に由来します。生命は、合成と分解の綿密に制御されたバランスによって維持されています。タンパク質のリサイクルは、生命に欠かせない仕組みなのです。
タンパク質代謝の分野で初期の先駆者であるルドルフ・シェーンハイマーは、1930年代にタンパク質のターンオーバーという概念を提案しました。不運にも、彼のアイデアは広く受け入れられませんでしたが、1950年代になり、クリスチャン・ド・デューブがリソソームを発見すると、研究は飛躍的に発展しました。まもなくロックフェラー大学の研究者たちは、電子顕微鏡を用い、細胞が自身の細胞質成分をリソソームに送るプロセスを分析しました。そしてド・デューブは1962年、ギリシャ語で「自分を食べる」という意味で、これを「オートファジー」と名付けました。その後、グレン・モーティモアとペール・シェーグレンは、哺乳類におけるオートファジーの生理的役割と制御の問題に取り組み、有益な論文を残しました。これにもかかわらず、オートファジーの分子メカニズムに対する理解は、長年の間、初期段階を脱しませんでした。
スライド17枚目
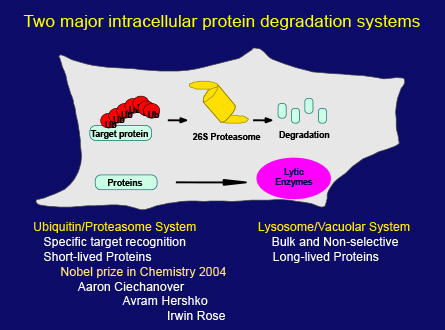
その間に、別の細胞内分解システムであるユビキチン―プロテアソーム系が発見されました。このシステムがさまざまな細胞プロセスの制御に重要な役割を果たしていることが明らかになると、タンパク質分解は、生物学研究会で、突然、多大な注目を集めるようになりました。最終的に、ここ(スライド17枚目)に挙げた3人の科学者が2004年ノーベル化学賞を受賞しましたが、リソソーム経路による分解とオートファジーの分野はまだ注目されませんでした。
さて、私の研究に戻りましょう。液胞が分解コンパートメントだと仮定して、私の疑問は、細胞質のどんな構成要素が、いつ、どうやって、液胞の膜を通り抜け、液胞酵素に届くかでした。最初に調べたのは、酵母のライフサイクルの中の、どんな条件で大量のタンパク質が分解されるかです。胞子形成は、4つの胞子を生成する減数分裂であり、アミノ酸の必須要素である窒素源の枯渇(飢餓)によって誘起されます。私は、細胞をこのように劇的に再構成するには、既存のタンパク質を分解して必要なタンパク質を作る必要があるだろうと考えました。
正直に言って、私は酵母の細胞を光学顕微鏡で観察するのが大好きです。液胞は比較的大きく、細胞内で唯一はっきり見えるオルガネラです。そして液胞の中は塩水のようなものです。ですから、液胞の中に構造があれば、簡単に見えるはずでした。私はたぶん、当時、誰よりも長く光学顕微鏡の前に座っていたと思います。
胞子形成の早期段階を入念に観察しましたが、細胞に大きな変化が見られません。これは液胞内の構造が分解されるせいかもしれないと考えました。そこで液胞内プロテアーゼ欠損株を使用し、分解を防ぐことを思いつきました。ありがたいことに、エリザベス・ジョーンズさんが多くのプロテアーゼ欠損株をYeast Genetic Stock Center(酵母遺伝株センター)に寄付してくださっていました。私はそれらの株を手に入れ、窒素源飢餓培地に切り替えました。
顕微鏡をのぞくと、たくさんの球型の粒が液胞内を激しく動き回っているのが見えました。このような構造は培養を始めて30分もしないうちに現れ、3~4時間後には液胞を完全に満たしました。私にとって、この観察は27年以上に及ぶオートファジー研究のまさに出発点でした。この現象を、一般的な低倍率の光学顕微鏡だけで発見できたのは、動きのない酵母細胞の中で、これらだけがブラウン運動によって激しく動いていたおかげです。この劇的な変化によって私は、自分が未知の魅力的な現象を見つけたことを確信しました。まもなく竹重一彦さんは、この現象が胞子形成に限らず、さまざまな栄養飢餓状態に対する細胞の一般的な反応であることを証明しました。
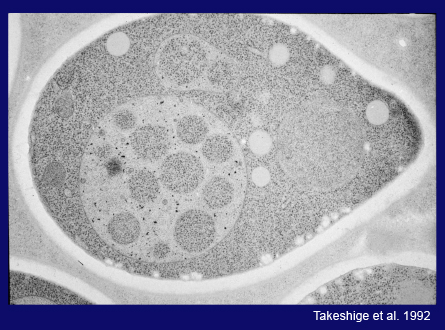
次に私は、電子顕微鏡の高い技術を持つ馬場美鈴さんと大隅正子さんに、この細胞内の現象を電子顕微鏡で撮影してほしいと頼みました。以下の数枚のスライド(スライド24枚目)でお見せするように、2人は、オートファジープロセスのすべてを決定的な美しい画像に捉えてくれました。これ(スライド24枚目)は、窒素源飢餓培地で3時間培養した細胞の超薄切片の画像です。液胞内に粒状の構造が見えます。この高倍率画像(スライド25枚目)では、これらの構造が1枚の膜で包まれていて、中身は細胞質とまったく同じ、含まれるリボソームや各種の細胞質構造の密度も同じであることがわかります。こちらの粗い電子顕微鏡写真(スライド25枚目)は、細胞質成分が非選択的に囲い込まれていることを示しています。また、液胞のすぐ近くの細胞質を包んだだけの袋状の隔離膜も観察しました。膜の伸長が終わり、口が閉じると、二重膜構造を持つオートファゴソームが形成されます。
スライド24枚目
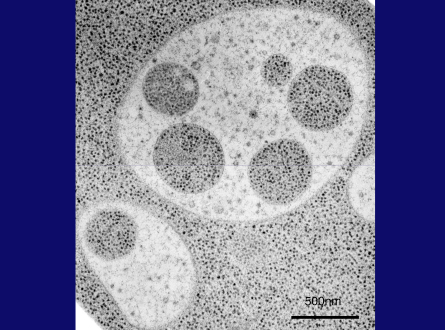
スライド25枚目
この冷凍割断画像(スライド28枚目)は、オートファゴソームが液胞膜と融合し、オートファゴソームの外膜が液胞膜とつながっている様子を示しています。ここ(スライド28枚目)には、私たちがオートファジックボディと名付けた内膜構造も見えます。オートファジックボディには、こことここ(スライド29枚目)に見られるように、時折、ミトコンドリアが含まれます。これは、オートファジーが、細胞質タンパク質だけでなく、リボソームなどの超分子構造、あるいはオルガネラ全体まで分解できることを示しています。これがオートファジーの特徴です。
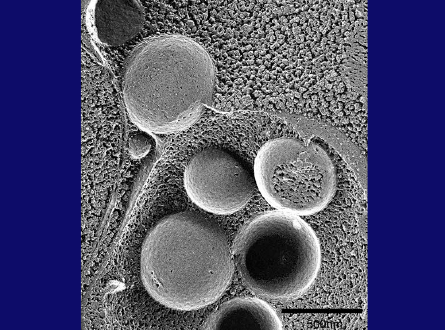
スライド28枚目
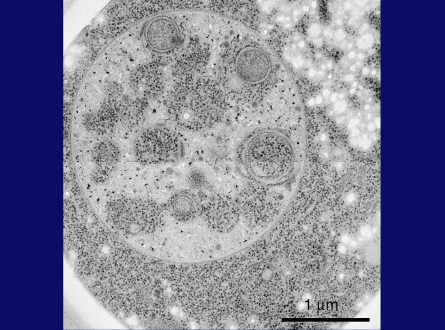
スライド29枚目
 スライド30枚目
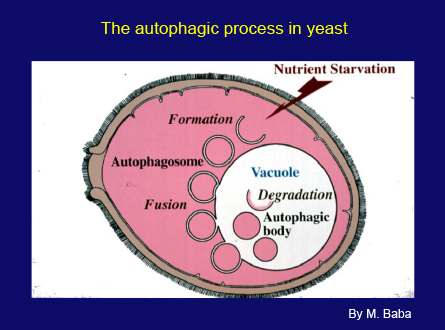
スライド30枚目
このスライド(スライド30枚目)は、酵母のオートファジープロセスの図解です。細胞が飢餓状態になると、小さな袋状の膜が液胞の近くに現れ、広がって細胞質の一部を包み込みます。次に、二重膜構造であるオートファゴソームが液胞をめざして液胞膜と融合し、内膜で包まれた構造を液胞内に放出します。野生型の細胞では、これらの構造はすぐに液胞酵素によって分解されます。しかしプロテアーゼの欠損した変異体では、オートファジックボディの蓄積としてオートファジーの進行を観察できます。このプロセスの膜動態は、哺乳類のオートファジーと基本的に同じです。ただ、液胞のほうがリソソームよりはるかに大型です。
ご存じのように酵母は、遺伝子解析を通じて複雑な生物学的現象を解き明かすのに非常に良い生物です。私は、細胞分裂周期(CDC)変異株によって細胞周期を解明したリーランド・ハートウェルさんの研究、そしてsec変異株を使用して分泌経路を明らかにしたランディ・シェクマンさんの研究にも、強い感銘を受けました。
そして、次にオートファジー不能変異株を取得し、オートファジーに関与する遺伝子を見つけようと考えました。しかし、当時は、オートファジー不能になった細胞がどうなるのかわかりません。単純な形態観察で、飢餓条件下でオートファジックボディを蓄積しない変異株を選別することにしました。私の研究室の最初の大学院生の1人だった塚田美樹さんは、この選別に大きく貢献してくれました。変異を起こさせた細胞を培養し、何千個もの細胞を1つひとつ観察してオートファジックボディを持たない変異株を探すことにより、彼女は最初のオートファジー不能変異株を見つけ、私たちはそれを「apg1-1」と名付けました(後にatg1に改名)。この変異株は、明らかに飢餓条件下でタンパク質を分解できませんでしたが、栄養豊富な培地では正常に成長し、他に明らかな表現型はありません。しかしまもなく、atg1変異株は、飢餓が長期にわたると野生型の細胞より早く死ぬことがわかりました。この表現型がオートファジー不能に起因すると仮定し、塚田さんは、今度は変異を起こさせた細胞の中から死にやすい株をまず選ぶことで、約100個のオートファジー不能変異株を分離することに成功しました。遺伝解析の結果、これらの株には14のatg変異株がありました。今では、飢餓条件下の酵母でオートファジーが生じるには18個のATG遺伝子が必須であることがわかっていますから、当初の選定は非常に有効だったと言えます。まもなく電子顕微鏡を使用した研究で、これらのすべてのatg変異株で、オートファゴソームの形成というオートファジーにおける最も重要な現象が生じないことが示唆されました。
次の目標は、各ATG遺伝子によって合成されるタンパク質を特定することでした。最初の遺伝子、ATG1は、タンパク質キナーゼの遺伝子であることがわかりました。しかし、私たちや他のグループがクローニングしたATG遺伝子のほとんどはまったく新しいもので、機能についてアミノ酸配列からわかることはありませんでした。私たちにとっては辛い時期でした。
教養学部にある研究室は小さく、高度な設備はありませんでした。資金は限られていて、メンバーは数人しかいません。しかし、その研究室での8年間が私のオートファジー研究の基盤であることは間違いありません。
1996年、私は愛知県岡崎市にある基礎生物学研究所の教授に着任し、非常に前向きな研究環境に恵まれました。吉森保さんを助教授に招き、研究室の一員として哺乳類の細胞におけるオートファジーの研究を始めてもらったほか、野田健司さんと鎌田芳彰さんにも助手として参加してもらいました。翌年、水島昇さんもポスドク研究員としてチームに加わりました。さらに年々、優秀な研究員や亀高諭さんをはじめとする大学院生が集まりました。帝京科学大学の大隅萬里子研究室の協力と酵母全体のゲノムプロジェクトのおかげで、ATG遺伝子のクローニングは思ったより速く進みました。

プロジェクターを指しながら
最初にブレークスルーを生んだのは水島昇さんです。彼はAtg12の生成物を調べていて2つのバンドを見つけ、片方の見かけの分子量が大幅に高いことに注目しました。また、atg5、atg7、atg10変異株にこの高分子量バンドがないことにも気づきました。詳細は省きますが、私たちは、新しいユビキチン様分子であるAtg12が、E1酵素のAtg7によって活性化され、E2酵素のAtg10に転移された後、唯一の標的タンパク質であるAtg5と結合体を形成することを発見しました。さらに、2つのAtg12-Atg5結合体がAtg16ダイマーによって複合体となります。この酵素系の発見によって、5つのAtgタンパク質の機能が一度に明らかになりました。
もうひとつ、私たちが関心を持っていた分子はAtg8でした。免疫電子顕微鏡法ではAtg8がオートファジー関連の膜に局在しており、膜の生物発生の良いマーカーだと思われたからです。桐浴隆嘉さんと一村義信さんという2人の優秀な大学院生は、別の結合システムを明らかにしました。Atg8は前駆体として合成され、プロテアーゼAtg4によって処理された後、やはりE1酵素のAtg7によって活性化され、Atg3に転移されます。しかし、タンパク質と結合体を作るのではなく、主要な膜リン脂質の1つ、ホスファチジルエタノールアミンと結合します。こうして、驚いたことにATG遺伝子の半分近くがこれら2つの結合システムに関与していることがわかりました。
1998年、野田健司さんは、細胞が栄養豊富な培地にあるときでも、ラパマイシンがオートファジーを誘導することを発見しました。ラパマイシンはTORキナーゼの阻害剤ですから、私たちはTORキナーゼが最も上流のオートファジーレギュレーターであると提案しました。一方、鎌田芳彰さんと船越智子さんは、オートファジーの早期段階を研究し、Atg13とAtg17がオートファジーの誘導に重要な役割を果たし、Atg1キナーゼの活性化に必要であることを明らかにしました。木原章雄さんも、オートファジーには、優勢であるPI3キナーゼ複合体IIとは異なる、特定のPI3キナーゼ複合体Iが必要であることを発見しました。
基礎生物学研究所で研究を始めてから10年の間に、私たちはさらに2つのAtgタンパク質を発見しました。そしてそれらは、相互に作用するだけでなく、Atg17とも作用し、Atg1キナーゼの活動を調節していることがわかりました。結論として、オートファジーには合計18のAtgタンパク質が必須であり、これらは6つの機能グループに分類されます。すなわちAtg1キナーゼとそのレギュレーター、特定のPI3キナーゼ複合体、2つの結合システム、唯一、膜貫通領域を持つ膜タンパク質のAtg9、そしてAtg2-Atg18複合体です。
また、基礎生物学研究所時代には、水島昇さんと吉森保さんが哺乳類のオートファジーの研究を始め、Atg12結合システムが哺乳類の細胞でも十分に保存されていることを見事に示しました。吉森さんは、酵母Atg8の相同分子であるLC3がオートファジー進行の非常に有効なマーカーとして使えることを決定的に証明しました。この時期、仲間の2人である花岡秀樹さんと吉本光希さんは、植物細胞におけるATG遺伝子の同定に成功しました。ATG遺伝子の相同性は低いものの、Atgシステムは酵母、哺乳類、植物間で良く保存されています。つまり、オートファジーの中核的な仕組みは、進化の早期に獲得されたのでしょう。
オートファジーに必須のATG遺伝子の特定は、オートファジー研究情勢を一変させました。画期的だった点の1つは、Atgタンパク質をマーカーとしてオートファジーのプロセスを蛍光顕微鏡で観察できるようになったことです。水島昇さんは、この点を利用し、GFP-LC3を表現するトランスジェニックマウスを作製しました。このツールにより、マウスの体の各組織でどれだけオートファジーが起こっているかを判断できます。このマウスは世界中の研究室と共有されています。水島さんは、ATG遺伝子ノックアウトマウスも開発しました。これにより私たちは、オートファジーが出生時の生存に決定的な役割を果たすことを証明できました。小松雅明さんは、ATG7遺伝子のコンディショナルノックアウトがユビキチン化タンパク質を蓄積させ、最終的に肝臓に腫瘍を作ることも実証しました。このときから、さまざまな生物、細胞の種類、組織、臓器、個体におけるATG遺伝子の操作が世界中の多くの研究室で始まり、オートファジーの幅広い生理機能が明らかになりました。オートファジーとさまざまな病気の関連も明らかになりつつあります。オートファジーのこのような急速な広がりは、世界中のオートファジー研究者の協力がなければ、ありえなかったでしょう。しかし、この広大な分野は、酵母における私の基礎研究に重点を置くという本日の講演の範囲外です。
前にも述べたように、栄養のリサイクルはオートファジーの最も基本的な機能であり、栄養の制限、すなわち飢餓という持続的な課題に対する進化的な適応です。近年の研究では、オートファジーには別の重要な機能があることもわかりました。細胞質の大量リサイクルに加え、細胞質から過剰な、または有害な物質を選択的に抜き取ることができるのです。このような分解の対象には、特定のタンパク質、超分子複合体、タンパク質凝集体、オルガネラのほか、ウイルスや侵襲性細菌まで含まれます。オートファジーが細胞質の恒常性維持に不可欠な役割を担っていることは、現在では広く認められています。このようにオートファジーの不全は、さまざまな異常、健康上の問題、疾病の原因となりかねません。この種のオートファジーは一般にランダムではなく、選択的です。ダニエル・クリオンスキーさんは、やはり酵母を使用し、初めて同定された選択的オートファジーのモデルシステムであるCvt経路を研究しています。酵母では、選択的オートファジーの受容体が複数同定されています。今や、オートファジーの各種の選択モードは、オートファジー研究の中でも極めて活気ある分野になりました。私たちはようやく、このような選択的なオートファジー、たとえばミトコンドリアオートファジーのようなタイプを明確に理解し始めたばかりです。しかしこれは、さらなる研究によって具体的な分子の詳細を知る必要のある分野です。
単純な酵母のシステムにさえ、まだ解明できていない多くの基礎的な問題があります。だからこそ私のグループは、今でも酵母のオートファジーに取り組んでいます。オートファゴソーム形成のコア要素はすでに同定しましたが、それらのタンパク質が細胞内のどこで、どのように機能するのかという疑問は残っています。鈴木邦律さんは、この分野に大きく貢献されました。まず彼は、オートファジーが誘導されるとき、ほとんどのAtgタンパク質が、少なくとも部分的に、液胞に隣接するドット構造に局在することを発見しました。また、このドット構造からオートファゴソームが生成されることを示し、オートファゴソーム前駆体(preautophagosomal structure, PAS)と名付けました。私たちは、PASがどのように体系化されるかを明らかにするため、Atgタンパク質の相互関係を系統的に分析し、このスライド(スライド52枚目)に示すように、6つの機能グループの因果関係を発見しました。これが、以降の研究の枠組みとなりました。蛍光顕微鏡の近年の発達のおかげで、私たちは細胞内のAtgタンパク質を観察できるようになり、ほとんどのAtgタンパク質が、成長条件下では細胞質内を自由に動いていることがわかりました。飢餓状態になると、各Atgタンパク質のうちの少量がPASに誘導されます。現在では、Atgタンパク質同士の階層的関係が、オートファゴソーム形成中に生じる事象の時間的順序を反映していることがわかっています。
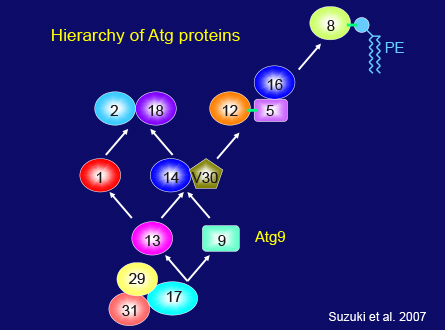
スライド52枚目
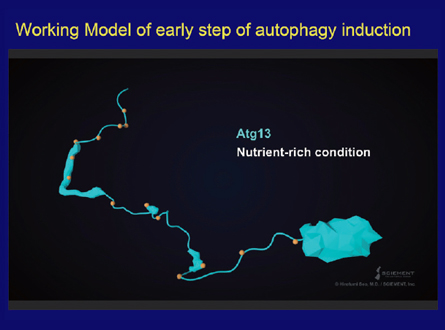
スライド63枚目
野田展生さんと故稲垣冬彦博士との長年にわたる緊密な協力により、多くのAtgタンパク質とその複合体の構造情報を提供していただきました。それらはAtgタンパク質の機能を理解する上で極めて重要でした。
さてここで、オートファゴソーム形成の早期段階に関する近年の研究を簡単にご紹介しましょう。ほとんどは、山本林さんと野田展生さんによるものです。主要タンパク質であるAtg13は、N末端の球状ドメインと長い天然変性領域で構成される独自の構造を持ちます。この変性領域は、TOR1キナーゼによる多くのリン酸化アミノ酸を含みます。飢餓条件下では、Atg13がすぐに脱リン酸化し、変性領域の特定の部位を介してAtg1およびAtg17と結合します。そして、Atg1、Atg13、Atg17、Atg29、Atg31複合体のダイマーが形成されます。ダニエル・クリオンスキーさんのグループによる研究は、PASでは実際に30~40のAtgタンパク質が合成されると示唆しています。このさらなる合成はどのように実現するのでしょう?私たちは、Atg13に、もう1つ弱いAtg17結合部位があり、これもPAS形成とオートファジーに不可欠であることを突き止めました。ここで、PASの早期組織のイメージを動画(スライド63枚目)の中でご紹介しましょう。ご覧のようにAtg13には、N末端の球状ドメインと長い天然変性領域があります。Atg13のこの領域に、このようにAtg1キナーゼが結合します。次に、Atg17-29-31複合体がAtg17結合部位を介して誘導されます。私たちは、ここに示すように、2番目の結合部位がPAS形成とオートファジーに不可欠であることを発見しました。Atg13は、1つのAtg17タンパク質で、両方の結合部位を使用することができません。2つのAtg17分子をリンクすることでPAS足場タンパク質を作ります。こうすれば、この足場タンパク質が大きなアセンブリを形成できます。このアセンブリは、隣接するAtg1分子間の自己リン酸化によるAtg1キナーゼの活性化に不可欠です。この活性化は、膜形成の次の段階に必要なものです。最近、鈴木翔さんは、Atg13のN末端ドメインがAtg9の変性領域に結合し、Atg9小胞をPASに誘導する第一歩となることを明らかにしました。このような数々の発見は、PASは静止したものではなく、実は多数のAtgタンパク質と膜構造によって構成される動的で柔軟な構造であることを示しています。膜形成の間、PASは、タンパク質修飾や過渡的アセンブリの形成を通じて、協調的な形で時間空間的に調節される必要があります。オートファゴソーム形成の後期段階については、まだ詳細に分析する必要があります。
現在、私のグループは、酵母におけるオートファジーの生理学的意味に重点を置いています。ある意味で、ぐるっと回って最初の疑問、つまりオートファジーによって何が、いつ、どのように分解されるのかという基本的疑問に戻ってきたような感じです。最新の解析ツールを使用し、杭沆黄(Hanghang Huang)さんと川俣朋子さんは、オートファジーによって大量のRNAが分解され、生じたベースが細胞から放出されることを示しました。今後は、分解プロセスの詳細を明らかにし、オートファジーの分解生成物を評価することによって、液胞から細胞質へどのように輸送され、細胞の代謝にどのような影響を与えるのかを知る必要があります。
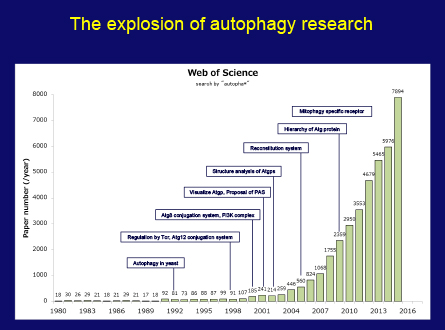 スライド67枚目
スライド67枚目
私のオートファジー研究は、これまで常に、知的好奇心と、細胞のタンパク質ダイナミクスをもっと理解したいという渇望に動かされてきました。研究を始めたときは、これほど短期間に、神経変性、感染症、癌など、さまざまな疾病に関連してくるとは思っていませんでした。しかし現在、オートファジー研究は生物学の主要分野です。この図(スライド67枚目)は、オートファジー関連の論文数の急速な増加を示しています。この大部分が、世界中の多くの研究者の多大な努力によるものであることは言うまでもありません。ですから、そのすべての研究者に心よりお礼を申し上げ、この栄誉を共有したいと思います。
この図(スライド67枚目)を見ると、1つの研究分野が確立されるのに時間がかかることもわかります。科学において本当に独創的な発見は、予想外の思いがけない小さな発見をきっかけとすることが少なくありません。近年は、基本的な発見と実際的な応用までの距離が短くなりつつあります。これはすばらしいことですが、科学者は、研究が即座に実際に応用できるという証拠を提示するよう求められます。私は、社会が、目的を重視した科学だけでなく、文化活動の中核としての科学を育むことを心より願っています。
私の小さなアイデアと何十年かの研究がオートファジーを通じて基礎科学に貢献し、ノーベル財団が賞によってこの研究の基本的な性質を認めてくださったのであれば、基礎科学者としてこれほどうれしい、満足なことはありません。
最後に、私は研究人生を通じて幸運に恵まれたことに感謝しています。良い仲間がこの旅をともにしてくれ、多くの共同研究者による多大な労力、良い友人、多くの継続的な助成金、そして思いやりのある家族、特に妻の萬里子が私を支えてくれました。
ご清聴ありがとうございました。


ステージ上で記念撮影
※ ノーベルレクチャーの全スライドは以下のページに掲載されています。
公開日:2017年5月12日