東工大ニュース
東工大ニュース
公開日:2022.09.29
国立大学法人東京工業大学 物質理工学院 応用化学系の田中克典教授(理化学研究所開拓研究本部 主任研究員)と国立大学法人東海国立大学機構 名古屋大学 大学院創薬科学研究科の横島聡教授らの研究グループは、植物由来の毒性成分として知られるピロリジジンアルカロイドの活性本体を、がん細胞の近傍で合成(現地合成)することで、がん細胞の増殖阻害に成功しました。
ピロリジジンアルカロイドは肝毒性を示すことが知られていますが、本手法を用いることでその毒性を回避することが可能となり、新たながん治療法の開発へとつながることが期待されます。また、本成果は、過去に毒性が問題となり抗がん剤開発が中止された分子であっても、「現地合成」を活用することで、新たながん治療へ応用できる可能性を示しています。
本研究成果は、2022年9月24日付ドイツ化学会誌「Angewandte Chemie International Edition」に掲載されました。
本研究は、日本医療研究開発機構(AMED)「生命科学・創薬研究支援基盤事業(BINDS)」「先端的バイオ創薬等基盤技術開発事業」および文部科学省 卓越大学院プログラム「トランスフォーマティブ化学生命融合研究大学院プログラム(GTR)」の支援のもとで行われたものです。
ピロリジジンアルカロイドは、キク科、マメ科を含む約6,000種の植物に含まれている化合物であり、摂取することで肝障害を引き起こすことが知られています。ピロリジジンアルカロイドは体内に吸収されると、肝臓に存在する代謝酵素[用語2]により酸化を受け、ピロール構造[用語3]を含む分子(活性本体)に変換されます。この活性本体はピロール構造のもつ特性により強力なアルキル化剤[用語4]として働き、体内に存在する核酸やタンパク質と結合することで、それらの機能を阻害します。ピロール構造を含む活性本体は反応性が高く、代謝酵素による酸化が行われる肝臓で強く毒性が発現され、肝障害を引き起こします。
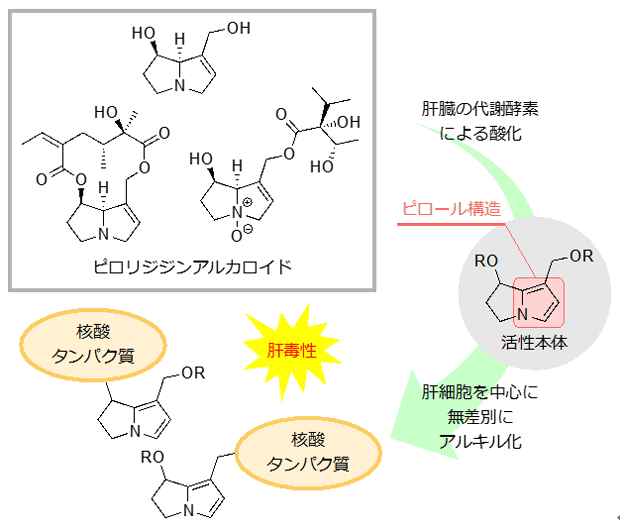
図1. ピロリジジンアルカロイドと肝毒性
ピロール構造を含む活性本体の反応性(強力なアルキル化剤)を基盤として、過去にピロリジジンアルカロイドの抗白血病治療薬としての開発が試みられ、臨床試験も実施されましたが、肝毒性が問題となり開発は中止されました。この臨床試験における肝毒性の問題は、ピロリジジンアルカロイドそのものが活性(毒性)を示すわけではなく、体内での代謝によりピロール構造を含む活性本体へと変換されることで初めて活性を示すという、ピロリジジンアルカロイドの活性発現機構と不可分の問題です。
そこで今回、ピロリジジンアルカロイドとは全く構造の異なる分子(前駆体)を投与し、がん細胞の近傍で、ピロリジジンアルカロイドの活性本体であるピロール構造を含む活性本体へと直接変換することができれば、毒性を回避してがん細胞の増殖を阻害することができるのではないかと考え、検討を行いました。
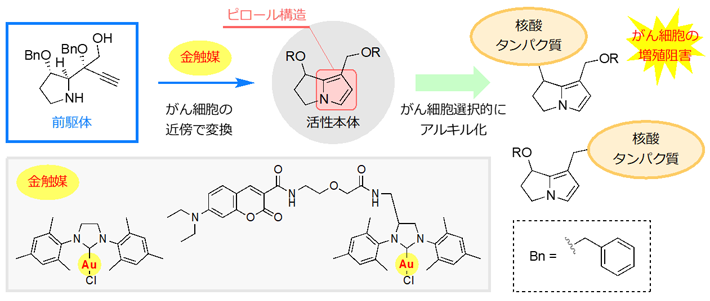
図2. ピロリジジンアルカロイド活性本体の現地合成
まず、ピロリジジンアルカロイドとは全く構造が異なり、ピロール構造を含む活性本体へと変換される分子(前駆体)の設計を行いました。設計にあたっては、金触媒を用いたアルキン[用語5]とアミン[用語6]の反応に着目しました。金触媒はアルキンを活性化し、アルキンとアミンを結合する反応を促進します。アルキンとアミンを同一分子内の適切な位置に配置しておくことで、ピロリジジンアルカロイドと同様の構造を形成し、更に脱離反応が進行することでピロール構造を含む活性本体が生成することが期待されました。目的とする前駆体は、市販の3-ヒドロキシプロリンから17段階で合成しました。合成した前駆体を金触媒と反応させたところ、目的とする反応が進行し、ピロール構造を含む活性本体へと変換されることが確認できました。金触媒は水溶液中でも反応を促進することが可能であり、本前駆体を用いてタンパク質および細胞を用いた実験へと展開しました。
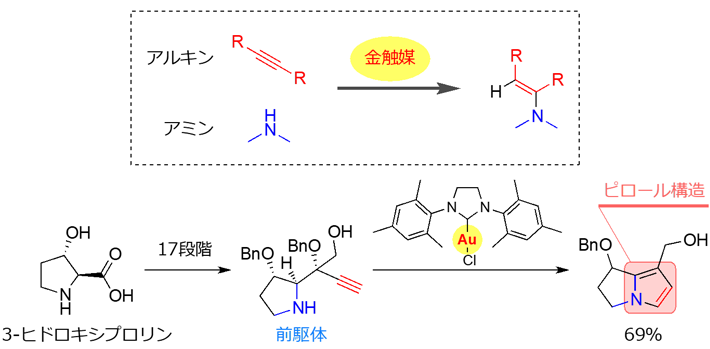
図3. 活性本体へと変換される分子(前駆体)の設計
前駆体に蛍光団(NBD)[用語7]を結合させた分子を用いて、タンパク質の一種であるアルブミンを含む溶液中で、金触媒による変換を試みたところ、アルブミンにNBDが導入されることが確認されました。このことは、ピロール構造を含む活性本体がアルブミンと期待通りに反応していることを示しています。続いて、各種がん細胞に前駆体と金触媒を作用させたところ、前駆体と金触媒を共存させることで、がん細胞の増殖阻害が確認されました。
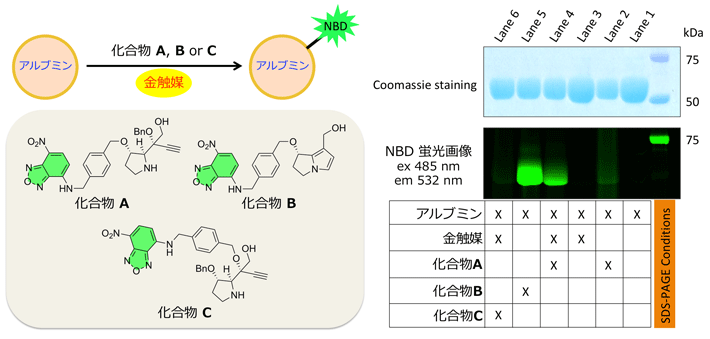
図4. 前駆体から変換された活性本体の反応
田中克典教授らのグループは、金触媒をアルブミンタンパク質の疎水性部位に担持させて生体内の夾雑系でも触媒活性を効率よく発揮させる技術を開発しており、この人工金属酵素(アルブミンに担持させた金触媒:Alb-Au)を用いても、前駆体からピロール構造を含む活性本体への変換が可能であることが確認できました。さらに、糖鎖ががん細胞の表面を認識することを利用して、アルブミンの表面に複数の糖鎖を導入することで、がん細胞選択的にアルブミンを集積させる技術も開発しています。このグループが開発したこれらの技術を活用し、糖鎖が導入されたAlb-Auを用いてがん細胞の増殖阻害活性試験を行ったところ、標的とするがん細胞の顕著な増殖阻害が確認されました。すなわち、糖鎖と相互作用を示したがん細胞の近傍にAlb-Auが配置され、そのAlb-Auが前駆体からピロール構造を含む活性本体へと変換を行う「現地合成」により、細胞選択的な増殖阻害を実現することができました。
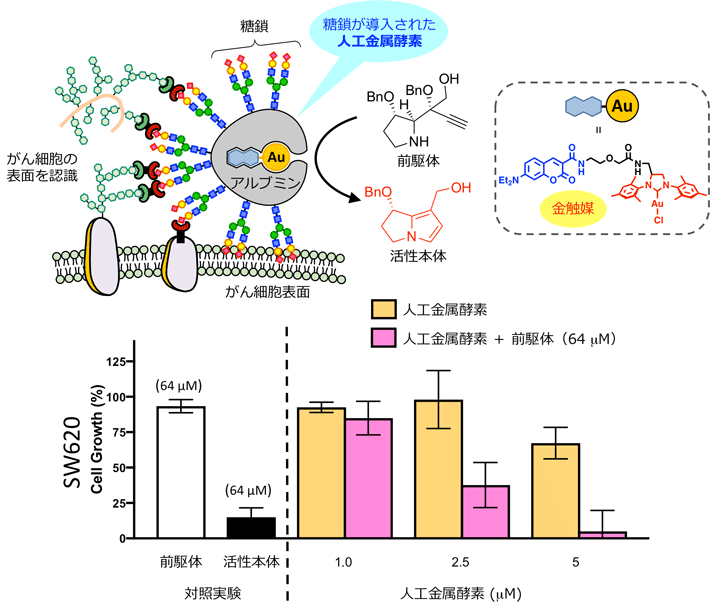
図5. 人工金属酵素を用いた活性本体のがん現地合成
本研究では、代謝されることで活性を示す天然物の活性本体を「現地合成」することで、がん細胞の増殖阻害を実現しました。本成果を生体内に応用することができれば、新たながん治療の手法になり得ます。また本成果は、過去に毒性が問題となり抗がん剤開発が中止された分子であっても、「現地合成」を活用することで、新たながん治療へと用いることができる可能性を示しています。
用語説明
[用語1] 糖鎖 : 糖が鎖状につながったもの。つながる糖の種類、糖同士のつながり方の違いで、多様な性質が生み出される。
[用語2] 代謝酵素 : 薬物や毒物を分解したり、体外に排出しやすい形に変換する機能をもつタンパク質。肝臓に多量に存在している。
[用語3] ピロール構造 : 一つの窒素原子と四つの炭素原子で構成される五角形の構造体。炭素—炭素結合は二重結合となっており、芳香族化合物の一種である。
[用語4] アルキル化剤 : 求核置換反応で共有結合を形成する分子のこと。シクロホスファミドやマイトマイシンCなど、がん治療に用いられているものもある。
[用語5] アルキン : 炭素—炭素三重結合を持つ化合物
[用語6] アミン : アンモニア(NH3)にアルキル基やベンゼン環などが結合した化合物
[用語7] 蛍光団(NBD) : 光のエネルギーを吸収し、より長波長(低エネルギー)の光を放出する構造体。
論文情報
掲載誌 : |
Angewandte Chemie International Edition |
論文タイトル : |
Anticancer Approach Inspired by the Hepatotoxic Mechanism of Pyrrolizidine Alkaloids with Glycosylated Artificial Metalloenzymes |
著者 : |
Michitaka Kurimoto, Tsung-che Chang, Yoshitake Nishiyama, Takehiro Suzuki, Naoshi Dohmae, Katsunori Tanaka, Satoshi Yokoshima |
DOI : |
お問い合わせ先
東海国立大学機構 名古屋大学 大学院創薬科学研究科 教授
横島聡
Email yokosima@ps.nagoya-u.ac.jp
Tel 052-747-6798 / Fax 052-747-6799
東京工業大学 物質理工学院 応用化学系 教授
理化学研究所 開拓研究本部 田中生体機能合成化学研究室 主任研究員
田中克典
Email tanaka.k.dg@m.titech.ac.jp
取材申し込み先
東海国立大学機構 名古屋大学広報室
Email nu_research@adm.nagoya-u.ac.jp
Tel 052-789-3058 / Fax 052-789-2019
東京工業大学 総務部 広報課
Email media@jim.titech.ac.jp
Tel 03-5734-2975 / Fax 03-5734-3661
理化学研究所広報室 報道担当
Email ex-press@riken.jp