東工大ニュース
東工大ニュース
公開日:2023.07.28
東京工業大学 物質理工学院 材料系の小笠原気八大学院生(当時)、同 国際先駆研究機構 元素戦略MDX研究センターの北野政明教授、宮﨑雅義助教、細野秀雄特命教授らは、六方晶チタン酸バリウム(h-BaTiO3−x)中の酸素イオン(O2−)の一部を窒素イオン(N3−)で置き換えた酸窒化物[用語1](h-BaTiO3−xNy)にニッケル(Ni)を担持したNi/h-BaTiO3−xNy触媒を開発し、既存のNi触媒に比べてアンモニア分解反応の動作温度を140℃以上低温化することに成功した。
Ni/h-BaTiO3−xNyの触媒活性は、当グループが以前に報告した世界最高レベルのアンモニア分解活性を示すカルシウムイミド(CaNH)[用語2]にNiを担持したNi/CaNH触媒に匹敵することが明らかとなった。Ni/CaNH触媒は、高いアンモニア分解活性を示すが、大気や水中で速やかに分解されて失活してしまうことが大きな課題であった。
一方、今回開発したNi/h-BaTiO3−xNy触媒は、水に暴露した後でも触媒性能が低下せず、構造も維持されることを明らかにした。本触媒では、h-BaTiO3−xNyの表面に存在する窒素空孔[用語3]で、アンモニア分子が活性化されるため、Ni以外の非貴金属(FeやCo)に対しても同様に優れた促進効果を示すことが分かった。今回の研究は、化学的安定性の高い酸窒化物をアンモニア分解触媒の担体材料に応用することで、高活性かつ高耐久性なアンモニア分解触媒の設計が可能であることを実証したことになる。
研究成果はドイツ科学誌「Advanced Energy Materials(アドバンスト・エナジー・マテリアルズ)」オンライン速報版に7月25日付で公開された。
近年、地球温暖化の主な原因物質とされている二酸化炭素の排出量の削減が国策として進められており、化石燃料にかわるクリーンなエネルギーとして水素(H2)が大きな注目を集めている。一方で、水素そのものを大規模に貯蔵・輸送するためには、極低温に冷却し液化する必要がありコストや技術的な課題が存在する。このため、水素を一時的に別の化合物に変換することで、水素を安定的・低コストで貯蔵・輸送する技術の開発が進められてきた。水素と窒素から合成されるアンモニア(NH3)は世界で最も多く合成される化合物の1つであり、室温・10気圧程度で液化するため有力な水素キャリア[用語4]として期待される。一方で、アンモニアから効率よく水素を取り出す有用な技術が見いだされていないことが、アンモニアの水素キャリアとしての課題である。
アンモニアを分解し水素を取り出す反応は、吸熱反応であるため反応温度を高温にするほど効率よく進行する。ルテニウム(Ru)を酸化物などの担体に固定した触媒がアンモニア分解反応を非常に効率よく促進することが知られているが、Ruは希少で高価な貴金属であることから安価な非貴金属を用いた代替触媒の開発が求められている。その代替候補の1つとして安価なニッケル(Ni)を酸化物担体に固定したしたものが知られているが、Ruと比較してNi触媒のアンモニア分解効率は低く、高いアンモニア分解効率を得るために800℃以上の高温で作動させる必要がある。このため、Niのような非貴金属を用いた触媒でも低温で高効率に作動するアンモニア分解触媒が求められている。近年、CaNHなどの非酸化物を担体とすることで、Ni等の非貴金属触媒の作動温度を大きく低温化できるとする研究成果が国内外の複数のグループから報告されている。しかし、これらの非酸化物担体は不安定であり大気中に暴露すると酸化され活性が大きく損なわれてしまう欠点があった。
本研究では、六方晶チタン酸バリウム(h-BaTiO3−x)中の酸素イオン(O2−)の一部を窒素イオン(N3−)で置き換えた酸窒化物 (h-BaTiO3−xNy)を担体としその上にNiナノ粒子を固定した触媒を創成した。以前の研究で開発した六方晶チタン酸バリウムの酸水素化物(h-BaTiO3−xHx)を窒素雰囲気下、600℃で加熱することにより、格子水素(H−)が窒素(N3−)に置換され酸窒化物(h-BaTiO3−xNy)が得られる。h-BaTiO3−xHx中の水素は、TiO6八面体が2量体を形成している面共有サイトに3つH−として存在するが、N3−が置換された際、電荷バランスの関係から空孔サイト(VN)も形成される(図1)。また、h-BaTiO3−xは白色の粉体であるが、h-BaTiO3−xNyは深い緑色を呈している。元素分析の結果から、組成はBaTiO2.00N0.34□0.66 (□ はアニオン空孔サイトを示す)であることが分かった。
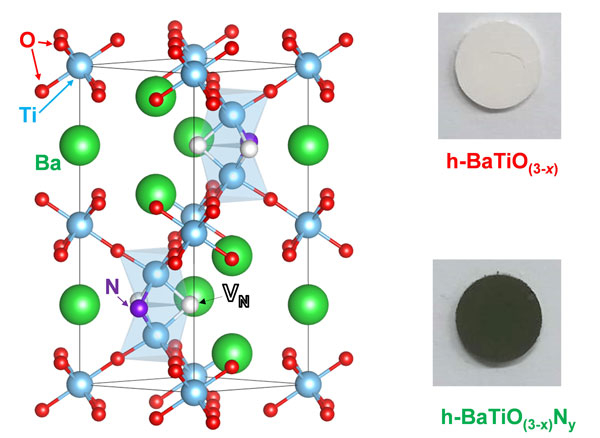
図1. 今回開発した酸窒化物(h-BaTiO3−xNy)の結晶構造と、酸化物(h-BaTiO3−x)および酸窒化物(h-BaTiO3−xNy)の外観写真。
図2に、種々のNi担持触媒の活性試験の結果を示す。Ni/h-BaTiO3−xNyは350℃付近からアンモニア分解活性を示し、580℃においてほぼ100%のアンモニア転化率に到達することが分かる。一方、同じ結晶構造を持つ酸化物にNiを担持した触媒(Ni/h-BaTiO3−x)では500℃程度から触媒活性を示すようになり650℃でも十分な触媒活性を示さなかった。このことから、担体を酸窒化物とすることで、アンモニア分解触媒としての作動温度が140℃以上低温化することが明らかとなった。また、Ni/h-BaTiO3−xNy触媒の活性は、以前当研究グループで開発されたNi/CaNHに匹敵する高い性能であることも示された。さらに、Ni/h-BaTiO3−xNy触媒のNi重量当たりの水素生成速度は、反応温度500℃で194.3 mmol gNi-1 min-1でありこれまで報告されているNi系触媒と比較して、世界最高レベルの触媒活性であることが明らかとなった。また、反応機構解析の結果から、Ni/h-BaTiO3−x触媒では従来の触媒と同様Ni表面でアンモニア分解反応が進行するが、Ni/h-BaTiO3−xNy触媒では担体であるh-BaTiO3−xNyと担持されているNiの界面に存在する窒素空孔サイトでアンモニア分子が活性化され、水素が生成するとともに窒素が空孔サイトに補足される。補足された窒素種は、担持されているNiの作用でN2として脱離することで空孔サイトが再生される反応機構であることが明らかとなった。このような反応機構により、非貴金属であるNiを使用しても低温で高いアンモニア分解活性を示したと考えられる。
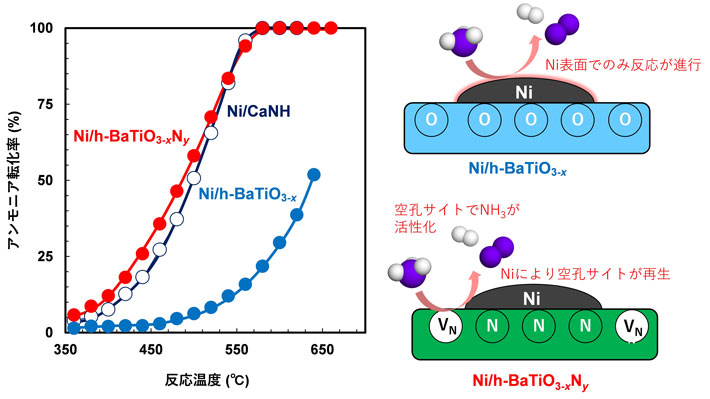
図2. (左)Niを種々の担体材料に固定化した触媒のアンモニア転化率と反応温度の関係。(Ni担持量:5wt%) (右)Ni/h-BaTiO3−x触媒およびNi/h-BaTiO3−xNy触媒の活性点の違い。
このようにNi/h-BaTiO3−xNyは、酸化物担持Ni触媒よりも低温で高いアンモニア分解活性を示すことが明らかとなったため、実際の運用を想定して、大気や水にさらされた際の安定性について検討した。反応後の触媒を水の中に1時間浸漬させ、乾燥させた後再びアンモニア分解活性を調べた結果を図3に示す。水に浸漬した後の触媒も元の触媒とほぼ同じ触媒活性が得られ、反応後の結晶構造なども全く変化していないことが分かった。一方、Ni/CaNHでは大気中に1時間暴露しただけで、触媒活性が半分以下に低下した。すなわち、Ni/h-BaTiO3−xNyは高いアンモニア分解活性と耐水性を兼ね備えた優れた触媒であることが示された。
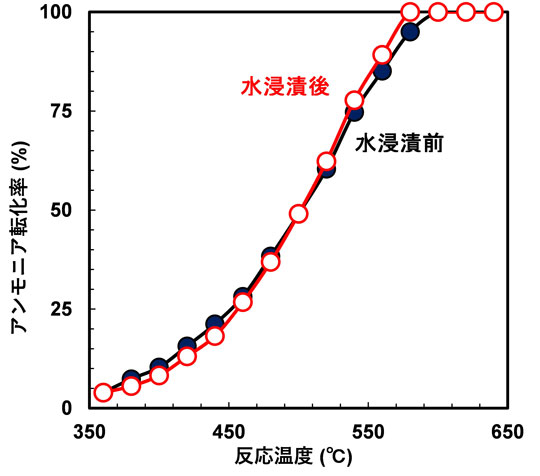
図3. 水への浸漬前後でのNi/h-BaTiO3−xNy触媒のアンモニア分解活性。
最後に、h-BaTiO3−xNyのアンモニア分解触媒担体としての有用性を調べるため、Ni以外の非貴金属であるFeやCoを担持した触媒活性を調べた結果を図4に示す。FeやCoをh-BaTiO3−xNyに担持した触媒も、Ni/h-BaTiO3−xNyと同程度の高いアンモニア分解活性を示し、それぞれの金属種を酸化物であるBaTiO3に担持した触媒よりも100℃以上低温で作動することが示された。h-BaTiO3−xNy上の担持金属種を変えても触媒活性に大きな差が出なかった理由は、担持金属表面ではなく、h-BaTiO3−xNy担体上の窒素空孔サイトが活性点として機能するためであると考えられる。
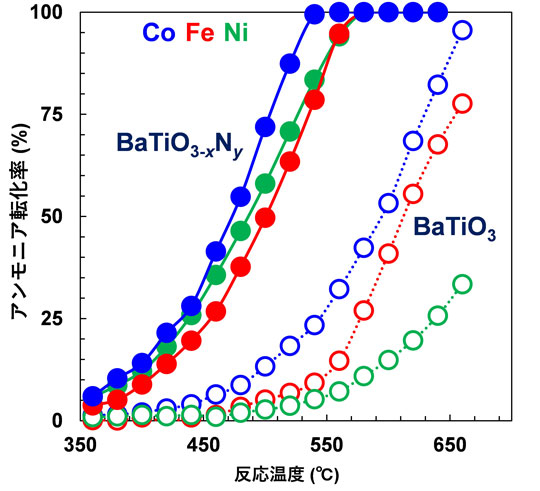
図4. さまざまな非貴金属を酸化物および酸窒化物担体に固定化した触媒のアンモニア転化率と反応温度の関係(各種金属担持量:5wt%)
アンモニアは、水素含有量が高く液化しやすいため水素の貯蔵・輸送のための水素キャリアとして有望であるが、アンモニアから水素を取り出し燃料電池や内燃機関などに利用するためには、低温プロセスで高効率に作動する触媒技術が求められている。また、コスト面も考慮すると、非貴金属触媒を利用することが必要不可欠であるが、従来技術では非貴金属触媒では低温化は困難であった。本研究において見いだされた酸窒化物を利用する触媒技術は、非貴金属を用いても低温で高効率に作動し、水に暴露しても触媒活性が低下しない極めて安定な触媒であるため、実用プロセスへの応用にも期待できる。
今回の研究は、h-BaTiO3−xNyをアンモニア分解触媒の担体材料とすることによって、従来の酸化物担体を用いた非貴金属担持触媒に比べて、より低温で高い触媒性能を得ることができた。さらに水に暴露しても活性が低下しない安定な触媒を実現した。また、アンモニア分解反応が担体中の格子窒素空孔サイトを介して進行するため、今後窒素空孔の役割をより詳細に解明することで、さらに高性能なアンモニア分解触媒の実現が可能になると期待される。酸窒化物は蛍光体の母材や光触媒材料として長年にわたり研究されてきた経緯があり、数多くの化合物が存在するためアンモニア分解触媒の有望な担体材料となりうる潜在的な物質が存在すると考えられる。本研究で実証した触媒設計を指針としてより高性能なアンモニア分解触媒が開発できると期待される。
付記
今回の研究成果は、JST創発的研究支援事業(JPMJFR203A)、科学研究費助成事業(JP22H00272、JP21H00019)、徳山科学技術振興財団などの支援によって実施された。
用語説明
[用語1] 酸窒化物 : 酸化物中の一部の酸素イオン(O2-イオン)が水素イオン(H-イオン)で置換された物質。
[用語2] カルシウムイミド(CaNH) : 2価の陽イオンと陰イオンであるカルシウムイオン(Ca2+)とイミドイオン(NH2-)が静電的な力で結びついた無機化合物である。食塩(NaCl)と全く同じ結晶構造を持ち陽イオンと陰イオンが交互に配列している。純粋なものは食塩と同様にほとんど無色である。
[用語3] 窒素空孔 : 窒化物、酸窒化物など格子に含まれるN3-の一部が、部分的に抜けた空きサイトを窒素空孔と呼ぶ。
[用語4] 水素キャリア : 水素を貯蔵・輸送するための媒体となる化学物質。アンモニアは、窒素原子1つに水素原子が3つ付いており、多くの水素を貯蔵できる。さらに、水素と比べて、簡単に液化できるため、水素の貯蔵・輸送を行うために便利な物質として注目されている。
論文情報
掲載誌 : |
Advanced Energy Materials |
論文タイトル : |
Ammonia decomposition over water-durable hexagonal BaTiO3−xNy-supported Ni catalysts (水安定な六方晶BaTiO3−xNyにNi担持した触媒上におけるアンモニア分解) |
著者 : |
Kiya Ogasawara, Masayoshi Miyazaki, Kazuki Miyashita, Hitoshi Abe,
Yasuhiro Niwa, Masato Sasase, Masaaki Kitano, Hideo Hosono
|
DOI : |
お問い合わせ先
東京工業大学 国際先駆研究機構 元素戦略MDX研究センター
教授 北野政明
Email kitano.m.aa@m.titech.ac.jp
Tel / Fax 045-924-5191
東京工業大学 栄誉教授
/同 国際先駆研究機構 元素戦略MDX研究センター 特命教授
細野秀雄
Email hosono@mces.titech.ac.jp
Tel 045-924-5009 / Fax 045-924-5339
取材申し込み先
東京工業大学 総務部 広報課
Email media@jim.titech.ac.jp
Tel 03-5734-2975 / Fax 03-5734-3661