東工大ニュース
東工大ニュース
公開日:2023.06.06
東京工業大学 科学技術創成研究院 細胞制御工学研究センターの志見剛特任准教授(研究当時)、木村宏教授、理化学研究所(理研)開拓研究本部眞貝細胞記憶研究室の福田渓客員研究員、志村知古テクニカルスタッフI、眞貝洋一主任研究員らの共同研究グループは、高次クロマチン[用語1a]構造の形成における抑制性クロマチン修飾[用語2]の意義を多面的に明らかにしました。
本研究成果は、老化に伴う細胞機能の低下・不全にヘテロクロマチン[用語1b]状態の変化が重要な役割を果たすとされる機構を理解する上で重要な知見です。
多細胞真核生物のゲノム情報は、転写活性化状態にあるユークロマチン[用語1c]と転写抑制状態にあるヘテロクロマチンに分かれて核内に格納されています。体細胞におけるヘテロクロマチンの大部分は、ヒストン[用語1d]H3の9番目のリジン(H3K9)のメチル化(特にトリメチル化)により覆われています。
今回、共同研究グループはH3K9メチル化を完全に欠損したマウス繊維芽細胞の確立に成功しました。H3K9メチル化を欠損するとエピゲノム[用語3]状態がダイナミックに変化し、別の抑制性クロマチン修飾であるヒストンH3の27番目のリジン(H3K27)トリメチル化がヘテロクロマチンを覆い、ヘテロクロマチンの核内局在、凝集、転写抑制など、ヘテロクロマチン形成におけるH3K9メチル化の機能を代替することで、ヘテロクロマチンを維持することが分かりました。
本研究は、科学雑誌「Nucleic Acids Research」オンライン版(5月13日付)に掲載されました。
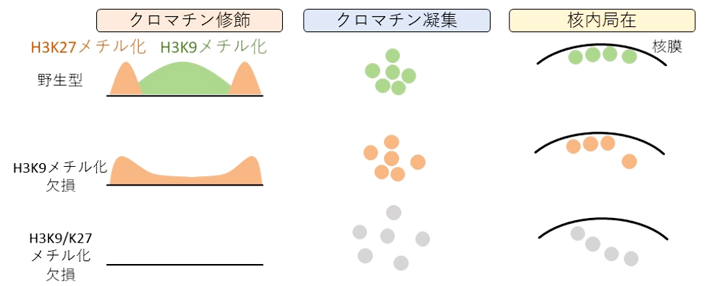
抑制性クロマチン修飾の欠損によるヘテロクロマチン構造の変化
転写不活性で凝集したクロマチン構造であるヘテロクロマチンは約100年前に発見されました。近年のエピゲノム解析や高次クロマチン構造の解析技術の発展により、ヘテロクロマチンは核膜[用語4]の近くに局在し、転写活性状態にあるユークロマチンから隔離されていることが明らかになってきました。ヘテロクロマチンは転写制御、ゲノム安定性、ゲノム複製などさまざまな核内現象に関わる重要な構造ですが、その形成機構の全貌はまだ明らかではありません。
ヘテロクロマチンの大部分は抑制性クロマチン修飾であるヒストンH3の9番目のリジン(H3K9)メチル化(特にトリメチル化)により覆われており、H3K9メチル化に結合するタンパク質HP1がクロマチンを凝縮させるため、H3K9メチル化がヘテロクロマチン形成に重要な働きを担っていると推測されていました。しかし、哺乳類においてH3K9メチル化酵素は5種類存在しており、それぞれが冗長的に機能するため、ヘテロクロマチン形成におけるH3K9メチル化の役割を調べるのは困難でした。
本研究では、5種類のH3K9メチル化酵素を全て欠損した細胞株を確立し、ヘテロクロマチン形成におけるH3K9メチル化の重要性を検証することを目指しました。
哺乳類は、SETDB1、SUV39H1、SUV39H2、EHMT1、EHMT2の5種類のH3K9メチル化酵素を持っています。福田客員研究員らは過去に、Setdb1、Suv39h1、Suv39h2の3つの遺伝子を欠損したマウス由来不死化線維芽細胞(3 knockouts immortalized mouse embryonic fibroblasts:3KO iMEFs)を樹立していました[参考文献1]。
今回、共同研究グループはCRISPR-Cas9システム[用語5]を用いることで、3KO iMEFsからさらにEhmt1とEhmt2を欠損した5KO iMEFsを作製することに成功しました。5KO iMEFsでは完全にH3K9メチル化が消失していましたが、細胞増殖能が維持されていたため、H3K9メチル化のない状態がクロマチン構造に与える影響を多面的に解析することが可能でした。
ヘテロクロマチンは、電子顕微鏡により電子密度の高い領域として確認することができます。5KO iMEFsのヘテロクロマチン状態を電子顕微鏡で解析すると、H3K9メチル化がないにもかかわらず、ヘテロクロマチンは維持されていました(図1右上)。5KO iMEFsにおけるエピゲノムを解析すると、別の抑制性クロマチン修飾であるヒストンH3の27番目のリジン(H3K27)トリメチル化が、ヘテロクロマチン全域を覆うように広がることが分かりました。H3K27トリメチル化はEZH1、EZH2という2種類の酵素で触媒されています。ヘテロクロマチン構造におけるH3K27トリメチル化の機能を調べるために、EZH1とEZH2の酵素活性阻害剤であるDS3201を野生型と5KO iMEFsに投与し、ヘテロクロマチン状態を解析しました。その結果、5KO iMEFsにDS3201を投与したサンプルでのみ、ヘテロクロマチンの消失が観察されました(図1右下)。
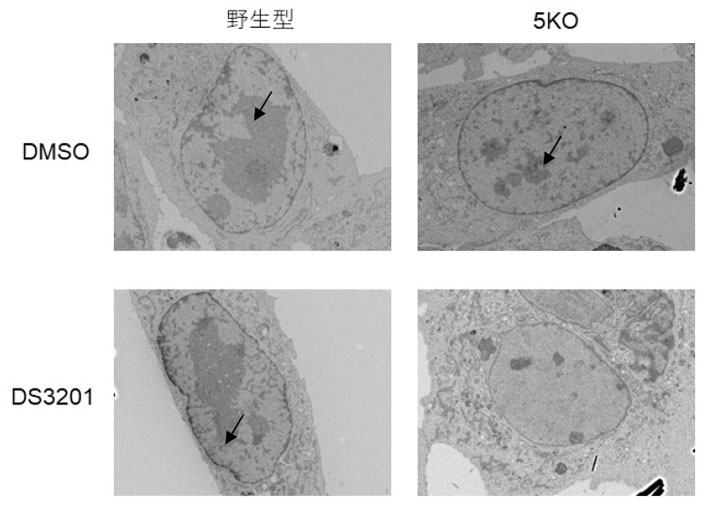
図1. H3K9メチル化とH3K27トリメチル化の欠損によるヘテロクロマチンの消失
野生型細胞にEZH1/EZH2阻害剤DS3201を投与しても、矢印で示されるヘテロクロマチンは維持されているが(左下)、5KO細胞にDS3201を投与すると、一部の細胞でヘテロクロマチンの消失が観察される(右下)。DMSO(ジメチルスルホキシド)は溶媒コントロールとして用いている。
次に、Hi-C法[用語6]とラミンChIP-seq法[用語7]により、ゲノム配列レベルでヘテロクロマチンの構造と核内局在を解析しました。すると、電子顕微鏡の結果と一致して、ヘテロクロマチン同士の近接度合いや核膜近くへの局在は、H3K9メチル化とH3K27トリメチル化の双方を欠損して初めて大きな変動が観察されました(図2下段)。以上の結果から、H3K9メチル化がなくなるとH3K27トリメチル化がその分布をダイナミックに変化させ、ヘテロクロマチンの核内局在、凝集、転写抑制などH3K9メチル化の機能を代替し、ヘテロクロマチンを頑健に維持していることが明らかになりました。
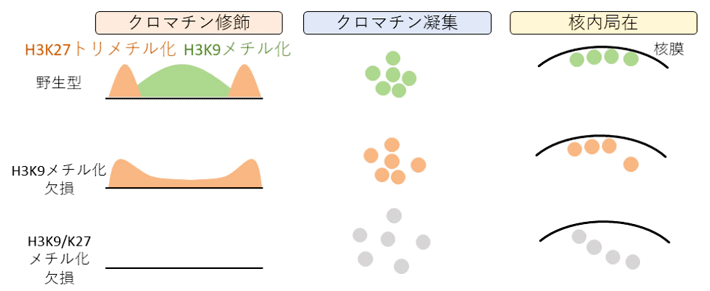
図2. H3K9メチル化、H3K27トリメチル化の欠損による核内クロマチン構造の変化
上段)野生型では、核内のヘテロクロマチンはH3K9メチル化とH3K27トリメチル化に覆われており、クロマチン同士は近接し、核膜周辺に存在する。
中段)核内ヘテロクロマチンのH3K9メチル化を欠損させると、残ったH3K27トリメチル化の分布は変化するが、クロマチン同士の近接や核内局在は野生型と比べてあまり変化しない。
下段)H3K9メチル化とH3K27トリメチル化の双方を欠損すると、ヘテロクロマチン同士の近接が減少するとともに、核膜周辺からヘテロクロマチンが離れる。しかし、この状態でもヘテロクロマチン構造を維持するゲノム領域もあり、H3K9メチル化およびH3K27トリメチル化非依存的なヘテロクロマチン維持機構の存在が示唆される。
本研究では、H3K9メチル化を完全に欠損した細胞を確立し、H3K9メチル化とH3K27トリメチル化を欠損した細胞の状態を解析することに初めて成功しました。H3K9メチル化の欠損によるエピゲノムの変化は、生殖細胞、初期発生、老化など生体内でも生じることが知られています。
また、H3K9メチル化とH3K27トリメチル化の双方が欠損しても、一部の細胞ではヘテロクロマチンが維持されていたことから、未知のヘテロクロマチン維持機構が存在すると考えられます。
今回作製した5KO iMEFsは、動的なエピゲノムの形成基盤やヘテロクロマチンを維持するバックアップ機構の全貌の解明に有用なツールとして期待できます。
研究支援
本研究は、理研新領域開拓課題「ゲノム構築原理の理解に向けて」、日本学術振興会(JSPS)科学研究費助成事業新学術領域研究「細胞分化にともなうクロマチンポテンシャルの変化とその分子基盤(研究代表者:眞貝洋一、18H05530)」「細胞核・クロマチン構造のダイナミクスと遺伝子制御(研究代表者:木村宏、18H05527)」、同基盤研究(A)「ヒストンH3K9メチル化修飾による転写抑制の包括的理解(研究代表者:眞貝洋一、18H03991)」「ヘテロクロマチン形成・維持の分子機構の解明(研究代表者:眞貝洋一、22H00413)」「ヘテロクロマチンに特徴的なヒストン修飾の排他性の意義とメカニズム(研究代表者:木村宏、21H04764)」、同基盤研究(C)「核ラミナが核膜孔複合体の構築を制御する分子メカニズムの解明(研究代表者:志見剛、20K06617)」による助成を受けて行われました。
用語説明
[用語1a] クロマチン :
[用語1b] ヘテロクロマチン :
[用語1c] ユークロマチン :
[用語1d] ヒストン :
ヒストンはH1、H2A、H2B、H3、H4の5種類からなるタンパク質で、DNAを巻き付かせて核内に高密度にパッキングさせる役割を担っている。ヒストンH2A、H2B、H3、H4の4種類8個のヒストンの周囲を147塩基対のDNAが巻き付いたヌクレオソームを基本単位として、複雑な高次構造を形成したものをクロマチンと呼ぶ。クロマチンは、凝縮したヘテロクロマチン領域と弛緩したユークロマチン領域に分かれており、ヘテロクロマチン領域では遺伝子の転写活性が低いことが知られている。ヒストンはさまざまな化学修飾を受けることで、遺伝子発現制御やクロマチンの高次構造の形成に関わる。
[用語2] 抑制性クロマチン修飾 : 転写の抑制と関連するクロマチン修飾の総称。代表的なものとして、H3K9メチル化やH3K27トリメチル化が挙げられる。
[用語3] エピゲノム : ゲノムDNAやDNAが巻き付いているヒストンタンパク質に見られる化学修飾の総体。エピゲノムの異常は、がんをはじめとするさまざまな疾患を引き起こすことが知られている。
[用語4] 核膜 : 真核細胞の核を取り囲む二重膜構造。核膜の主な役割は、核内のDNAを細胞質から隔離することで、DNAの保護や核内の生化学的プロセスの制御を行う。核膜の裏打ち構造を核ラミナと呼び、その主成分であるラミンはクロマチンと相互作用することで、転写や高次クロマチン構造を制御する。
[用語5] CRISPR-Cas9システム : バクテリアの免疫機構から発見された高効率な遺伝子編集技術。標的とするゲノム領域に塩基置換、挿入、欠損などさまざまなゲノム変異を導入できる。
[用語6] Hi-C法 : 染色体立体配座捕捉法とも呼ばれる。染色体の立体構造を解析するための手法の一つで、染色体上に存在する膨大なDNA塩基配列データを、その物理的な位置関係に基づいて解析することで、染色体の立体構造を再構成できる。Hi-Cはhigh-throughput chromosome conformation captureの略。
[用語7] ラミンChIP-seq法 : 核ラミナ(核膜の裏打ち構造)の主成分であるラミンに対する抗体を用いて、クロマチン免疫沈降を行い、得られたDNAを次世代シークエンサーで解析することで、核膜と相互作用するゲノム領域を同定する技術。
参考文献
[1] Fukuda et al, Commun Biol. 2021 May 13;4(1):571. doi: 10.1038/s42003-021-02089-y.
論文情報
掲載誌 : |
Nucleic Acid Research |
論文タイトル : |
Epigenetic plasticity safeguards heterochromatin configuration in mammals |
著者 : |
Kei Fukuda, Takeshi Shimi, Chikako Shimura, Takao Ono, Takehiro Suzuki, Kenta Onoue, Satoko Okayama, Hisashi Miura, Ichiro Hiratani, Kazuho Ikeda, Yasushi Okada, Naoshi Dohmae, Shigenobu Yonemura, Azusa Inoue, Hiroshi Kimura, Yoichi Shinkai |
DOI : |
お問い合わせ先
東京工業大学 科学技術創成研究院 細胞制御工学研究センター
教授 木村宏
Email hkimura@bio.titech.ac.jp
Tel 045-924-5742 / Fax 045-924-5973
取材申し込み先
理化学研究所 広報室 報道担当
Email ex-press@ml.riken.jp
Tel 050-3495-0247
東京工業大学 総務部 広報課
Email media@jim.titech.ac.jp
Tel 03-5734-2975 / Fax 03-5734-3661