東工大ニュース
東工大ニュース
公開日:2023.09.28
東京工業大学 物質理工学院 応用化学系の田中克典教授(理化学研究所(理研)開拓研究本部 田中生体機能合成化学研究室 主任研究員)、チャン・ツンチェ特任助教、理研 開拓研究本部のイゴール・ナシブリン特別研究員(研究当時)、吉岡広大特別研究員らの研究チームは、血液中でも数日安定で、大量の抗がん剤を体内で触媒的に生産できる世界初の遷移金属触媒[用語1]を開発し、マウス体内で本当に触媒的ながん治療を行うことに成功しました。
本研究成果は、少量の遷移金属触媒で実施可能な実用性の高い生体内合成化学治療[用語2]の例であり、副作用の少ない次世代の治療戦略として大きく役立つことが期待されます。
がん細胞だけを狙って血液中で抗がん剤を合成できれば、抗がん効果が高く副作用が少ない治療ができる可能性があります。一方、有機化合物合成における遷移金属触媒は、一般的に血液中では多くの生体分子から触媒活性(反応性)を阻害されかなり不安定であり、血中細胞に捉えられすぐに分解されたり排出されたりします。そのため、血液内でも十分に安定に存在し、触媒的に化学反応を進行させる遷移金属触媒は知られていませんでした。
今回、研究チームはこれまでに開発した遷移金属ルテニウム(Ru)を含む触媒を改良し、血液中での安定性と触媒活性を著しく向上させました。また、本触媒はマウス体内で抗がん剤を触媒的に合成することも可能であり、ほんの少量の触媒を用いるだけでがん治療効果を示すことが分かりました。
本研究は、科学雑誌『Chemical Science』のオンライン版(日本時間9月27日)に掲載されました。
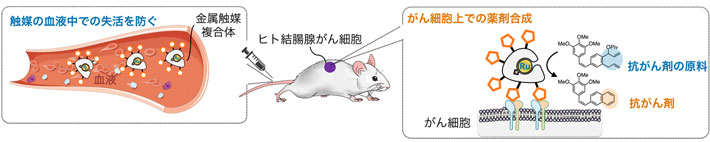
血液中で安定で高活性な金属触媒によるがん細胞選択的な抗がん剤合成
抗がん剤によるがん治療には副作用があります。これは抗がん剤が正常細胞にも毒性を示すことが一因です。このような副作用を抑える手法として、田中主任研究員らが開発した不活性な抗がん剤の原料(プロドラッグ[用語3])を投与し、がん細胞上でのみ活性な抗がん剤へ変換する生体内合成化学治療があります。
これまでに田中主任研究員らは、遷移金属であるルテニウム(Ru)の金属錯体[用語4a]から成る触媒(ルテニウム-塩素)を開発し、これと抗がん剤原料の投与により、生体内で抗がん剤の骨格を作るという新しい医薬品の合成法を報告しました※1。さらに、マウス体内の狙った細胞にルテニウム-塩素を移行させる技術※2,3を組み合わせ、副作用の少ないがん治療に成功しています※4(図1)。しかし以前の方法では、血液内でのルテニウム-塩素の反応性が低く、実際には体内で薬剤を合成するために量論量[用語5a]に近い金属錯体が必要とされ、多量に投与することが必要でした。世界中を見ても、本当に触媒量[用語5b]で血液内合成ができる触媒はこれまで存在しませんでした。生体内合成化学治療の実現には血液中でも高活性を保ち、投与量が少なくて済む真の触媒の開発が重要です。
そこで今回、研究チームは、触媒の構造変換と血液中での触媒活性評価によって、より高活性なルテニウム触媒の開発に挑みました。
![図1 ルテニウム-塩素による抗がん剤合成 アルブミン[6]の疎水性ポケットの中にルテニウム-塩素が結合し(吹き出し内の写真)、アルブミン表面にN型糖鎖(タンパク質中のアスパラギン残基に結合する糖鎖)が複数導入されている。アルブミンとルテニウム-塩素の複合体が体内のがん細胞へ選択的に移行し、その場で抗がん剤の原料を抗がん剤に変換する。](/news/img/news-33308-p1.jpg)
図1. ルテニウム-塩素による抗がん剤合成
アルブミン[用語6]の疎水性ポケットの中にルテニウム-塩素が結合し(吹き出し内の写真)、アルブミン表面にN型糖鎖(タンパク質中のアスパラギン残基に結合する糖鎖)が複数導入されている。アルブミンとルテニウム-塩素の複合体が体内のがん細胞へ選択的に移行し、その場で抗がん剤の原料を抗がん剤に変換する。
2019年7月2日 理化学研究所プレスリリース 触媒的「現地合成」によるがん治療|理化学研究所
2018年7月4日 理化学研究所プレスリリース がんを糖鎖のパターンで識別|理化学研究所
2020年10月21日 プレスリリース 糖鎖の不均一性を秩序よく高次化してがんを見つける|東工大ニュース
2022年1月10日 プレスリリース 体内でベンゼン環を作る|東工大ニュース
研究チームはまず、ルテニウム触媒の改良のため、塩素に代わる配位子[用語4b]を探索しました。その結果、塩素をヨウ素に置換すると血液中での安定性と反応性が向上することを明らかにしました(図2上)。ルテニウム-ヨウ素は血液中でも数日安定に存在し、極微量の1~5モルパーセント(mol%)で血液中での化学反応を進行させ、多くの化学反応においてルテニウム-塩素よりも変換率[用語7]が高いことが分かりました(図2下)。つまり、血液中でも真の意味での触媒量で化学反応を促進できる、生体内化学反応に適した遷移金属触媒を発見したと言えます。
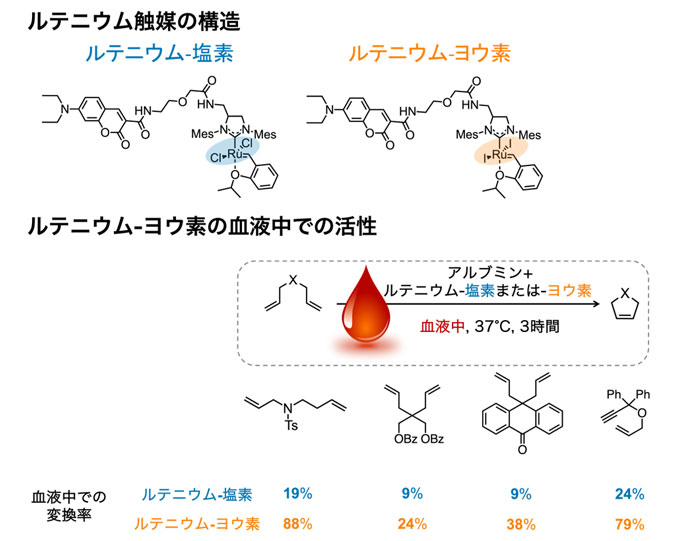
図2. ルテニウム-ヨウ素の構造と触媒活性
(上)ルテニウム-塩素とルテニウム-ヨウ素の化学構造式。構造の左側がアルブミンとの結合に重要な構造で右側(色を付けた部分)が触媒活性を担う構造。触媒活性に重要なルテニウム(Ru)周りの構造を変換することで、反応性を制御できる。
(下)ルテニウム-ヨウ素が血液中で触媒する、分子内で環を形成する反応(閉環メタセシス)と、それぞれの基質の変換率の例。2.5 mol%のルテニウム-ヨウ素を加えた血液中で、それぞれの基質を37℃で3時間反応させた。
次に、ルテニウム-ヨウ素が触媒する化学反応の種類を検証しました。すると、図2で示した分子内で環を形成する反応(閉環メタセシス)の他に、分子内でベンゼン環を形成する反応や、分子間で結合を形成する反応(クロスメタセシス)にも使えることが分かりました(図3)。特に、血液内で2つの異なる基質を選択的につなげるクロスメタセシスは不可能であると考えられていましたが、研究チームが開発したルテニウム-ヨウ素によって世界で初めて実現されました。これにより、生体内で構築可能な薬剤の幅が広がりました。
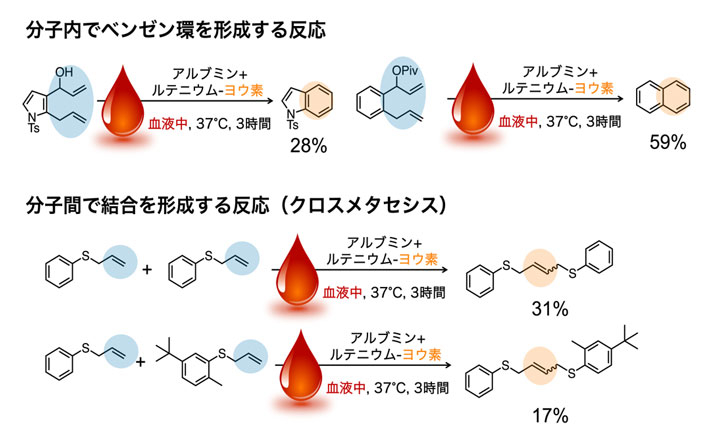
図3. 血液中でルテニウム-ヨウ素が触媒する反応
(上)血液中でルテニウム-ヨウ素によって分子内でベンゼン環を形成する反応の例。生成物の下の数字は変換率を示す。
(下)血液中でルテニウム-ヨウ素によって分子間の結合を形成する反応(クロスメタセシス)の例。同一の基質同士だけでなく、異なる基質同士の結合も触媒する。生成物の下の数字は変換率を示す。
さらに、がんモデルマウスを用いて、ルテニウム-ヨウ素を使った生体内合成化学治療の効果を評価しました。ヒト結腸腺がん由来細胞を移植した担がんマウス[用語8]に、抗がん剤のみ、またはルテニウム触媒(ルテニウム-塩素もしくはルテニウム-ヨウ素)と抗がん剤原料の組み合わせを投与し、抗がん活性を調べました(図4)。ルテニウム-塩素を用いた場合には、血液中の極少量の触媒量では抗がん剤を合成する反応がほとんど進まず治療効果が見られませんでした。これに対し、ルテニウム-ヨウ素では体内で触媒的に抗がん剤を合成できたため、顕著ながんの治療効果が見られました。さらに、これまでの薬剤処方に従って抗がん剤をマウス体内にマそのまま入れるよりも、がんの治療効果が高いことが分かりました。これは、がん細胞上で選択的に薬剤を合成して、薬剤の濃度を局所的に向上させることができるためと考えられます。これが、副作用の低減に並ぶ生体内合成化学治療の大きな利点です。
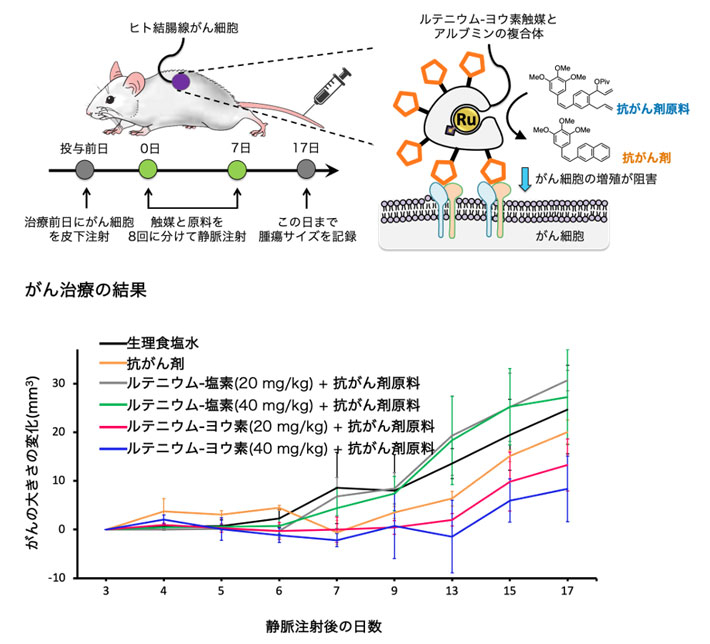
図4. ヒト結腸腺がん細胞移植マウスへの薬剤投与によるがん治療試験
(上)マウスにヒトがん細胞を皮下注射し、その翌日から8日間、1日1回ルテニウム触媒と抗がん剤原料を静脈注射した。ルテニウム-塩素もしくは-ヨウ素はアルブミンとの複合体として注射した。アルブミン表面にはがん細胞に移行する環状のペプチド(複数個のアミノ酸が脱水縮合してつながったもの。図中では五角形)を付与した。治療開始から数日おきに、皮膚上からがんをつまんで大きさを計測した。
(下)生理食塩水のみの群(黒)およびルテニウム-塩素+抗がん剤原料の群(灰、緑)に比べて、抗がん剤のみの群(黄)およびルテニウム-ヨウ素+抗がん剤原料の群(赤、青)ではがんの成長が抑制された。ルテニウム-ヨウ素+抗がん剤原料の群では、ルテニウム-ヨウ素の量を増やすと抗がん作用が増大した。
本研究で行ったルテニウム触媒の改良は、他のさまざまな遷移金属触媒にも応用できると考えられます。これにより、生体内で合成可能な分子の種類が広がり、生体内合成化学治療がさまざまな疾患に対する新しい治療戦略として発展することが期待できます。

左上からイゴール、向峯。左下から、中村、吉岡、田中、チャン、草苅
研究支援
本研究は、日本医療研究開発機構(AMED)先端的バイオ創薬等基盤技術開発事業「糖鎖付加人工金属酵素による生体内合成化学治療(研究代表者:田中克典)」による支援を受けて行われました。
用語説明
[用語1] 遷移金属触媒 : 周期表の第3族から第11族までに属する遷移金属元素を含む触媒。これらの元素は特定の官能基に対して強い親和性を示すため、さまざまな有機化学反応を触媒することが知られている。
[用語2] 生体内合成化学治療 : 通常はフラスコの中で行われる複雑な有機合成化学反応を、生体内(疾患部位)で行い、薬を体内で直接合成することで疾患を治療する手法。
[用語3] プロドラッグ : 生体内の薬剤標的部位での化学反応によって、薬効を示す分子に変換されるようにデザインされた薬剤。標的部位選択的に活性を示すため、副作用の軽減が期待できる。標的部位での化学反応には、生体内の酵素による触媒反応や生体内の低分子化合物との反応が主に用いられる。また、近年は生体内に導入した遷移金属触媒によって分子を変換する研究も進められている。
[用語4a] 金属錯体 : 金属錯体は、中心の金属イオンとそれを取り囲む分子からなる複合体。イオンを取り囲む分子を配位子という。
[用語4b] 配位子 : 用語4aを参照。
[用語5a] 量論量 : 化学反応に必要な触媒の量(mol数)が原料と同じかそれ以上の場合、その必要量を量論量という。一方、必要な触媒の量が原料より少ない場合は、その量を触媒量という。
[用語5b] 触媒量 : 用語5aを参照。
[用語6] アルブミン : 血清中の大部分を占め、分子量が6万程度の極めて安定な可溶性タンパク質。さまざまな薬物と配位する疎水性ポケットが存在し、血中でこれらの薬物を運搬する。
[用語7] 変換率 : 化学反応において、反応前の分子がどれだけ反応後の分子に変換されているかを示す割合。
[用語8] 担がんマウス : がん細胞をマウスへ移植した実験モデル。
論文情報
掲載誌 : |
Chemical Science |
論文タイトル : |
Catalytic olefin metathesis in blood |
著者 : |
Igor Nasibullin, Hiromasa Yoshioka, Akari Mukaimine, Akiko Nakamura, Yuriko Kusakari, Tsung-Che Chang and Katsunori Tanaka |
DOI : |
お問い合わせ先
東京工業大学 物質理工学院 応用化学系 教授/
理化学研究所 開拓研究本部 田中生体機能合成化学研究室 主任研究員
田中克典
Email kotzenori@riken.jp
Tel 048-467-9405 / Fax 048-467-9379
取材申し込み先
理化学研究所 広報室 報道担当
Email ex-press@ml.riken.jp
Tel 050-3495-0247
東京工業大学 総務部 広報課
Email media@jim.titech.ac.jp
Tel 03-5734-2975 / Fax 03-5734-3661