研究
研究

vol. 29
科学技術創成研究院 化学生命科学研究所 教授
西山伸宏(Nobuhiro Nishiyama)
紀元前400年に「医学の父」として知られる古代ギリシャの哲学者ヒポクラテスが「本当に良い薬は効いて欲しいところだけに効く薬である」と書物に残している。このように病気の細胞だけに作用する薬は、だれもが願う夢の薬であり、高分子※1を使ってこの夢の薬を実現しようと日々奮闘しているのが科学技術創成研究院の西山伸宏だ。

西山はこう説明する。「薬を作ることを創薬といいますが、これまでは低分子化合物※2の設計を中心に行われてきました。しかしながら、この従来の創薬プロセスでは薬剤が開発され尽くされた感があり、創薬は困難を極めています。今や創薬の成功確率は『3万分の1』と言われ、数百億円以上の莫大なコストと10年以上に及ぶ開発期間が必要とされているのが現状です。また、より効果の高い薬剤の開発が進められている一方で、副作用への懸念も高まっています。そこで高分子を使って、薬の開発や薬を病気の細胞だけに運ぶ研究に取り組んでいます。さらに、高分子をプラットフォームとして、病気の細胞にくっつく、病状を体外から見えるようにするなど、スマートな機能を付与すれば、今までにない夢の薬が実現できると思います」
実はこの“薬剤を体内の患部だけに送り込む”というアイデアは、「ドラッグ・デリバリー・システム(DDS)」と呼ばれ、高分子による医薬の概念も1970年代半ばには欧州の研究者によって提唱されていた(図1)。それがなぜ、現在になって注目されているのだろうか。
「低分子化合物の薬が中心であった時代には、まだ早すぎたのだと思っています。近年、従来の創薬が困難となってきたこと、患部へのデリバリーが必要不可欠な核酸医薬※3やバイオ医薬品※4が主流となってきたことで、DDSは再度注目を集めています。この30~40年の間に、高分子の合成技術が格段に進歩し、色々な高分子が作れるようになり、アプタマー※5や一本鎖抗体※6など高性能化のための機能性分子が利用できるようになったことで、高分子による夢の薬が実現できる時代がようやく到来したのだと考えています。過去には抗体医薬※7や核酸医薬も難しいと考えられていた時もありましたが、現在は医薬品の主流となりつつあります。同様に、高分子を使う創薬が、これからは重要になってくると私は信じています」と西山は主張する。
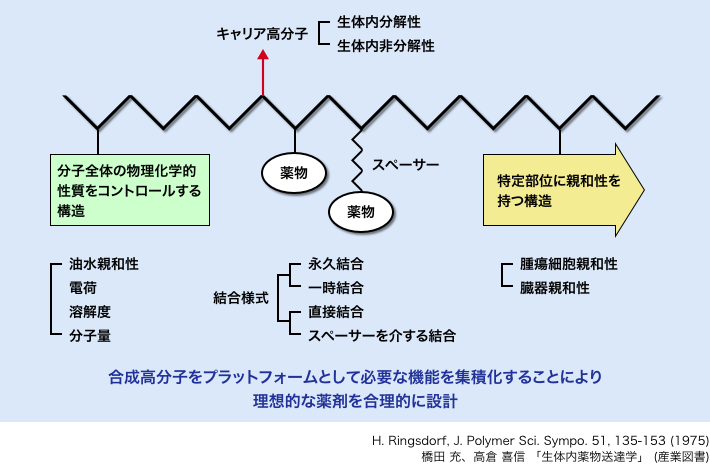
図1. 高分子科学者 H. リングスドルフによる高分子医薬モデル
近年、プレシジョン・メディシン(患者の個人レベルで最適な治療方法を選択し、それを施すこと)といった新たな医療の概念が生まれ、より高度な診断・治療技術が求められるようになってきた。これに伴い、DDSにも、単に薬を患部に送り届けるだけでなく、体内のあらゆる部位へと到達し、患部の微小な環境の変化に応答して、病状を体外へと発信したり、薬の放出速度を変化させたり、より高度な機能を持たせる必要が出てきた。1966年に米国で製作された『ミクロの決死圏』という映画は、ミクロ化された潜航艇が体内に入り、脳の出血部位を治療するというサイエンス・フィクション(SF)であったが、今まさに求められているのは、このような直径50ナノメートル(ナノは10億分の1)前後の高分子でできた微小カプセル「ナノマシン」の技術であり、DDSはナノマシンへと進化を遂げつつある。
西山は、DDS研究の第一人者として世界的に著名な現・ナノ医療イノベーションセンター(iCONM)・センター長の片岡一則博士の直弟子であり、過去に開発したDDSの一つにシスプラチンという抗がん剤を搭載したナノカプセル(高分子ミセル)がある。このナノカプセルは、30ナノメートルという大きさに設計されており、正常組織の血管は通過しないが、血管壁に大きな隙間が存在するがん組織で選択的に血管から漏れ出し、がん細胞のみを直接攻撃する。また、副作用を示すことなく、顕著な抗腫瘍効果を示す。現在、ヒトに対する臨床試験が行われており、一日も早い実用化が期待されている。
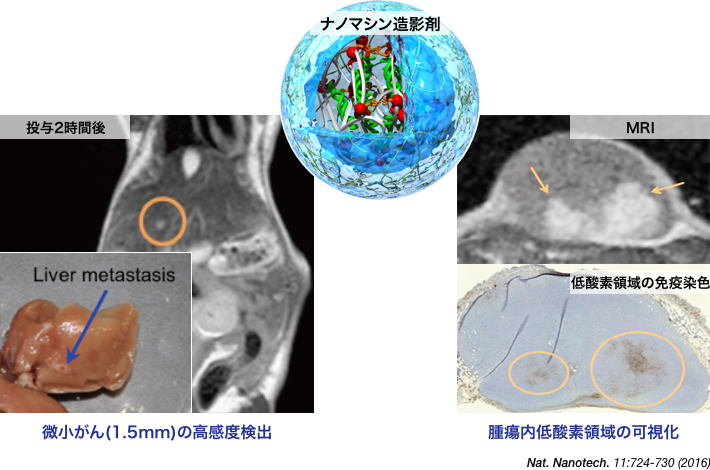
西山は、このような治療をより有効に行うために、2016年に「ナノマシン造影剤」を開発した(図2)。ナノマシン造影剤は、磁気共鳴断層撮影装置(MRI)用の造影剤として使用されるマンガンイオンを搭載しており、pH(水素イオン指数)の変化に応じてマンガンイオンを放出する機能を持っている。がんは、グルコース※8代謝が活発化することにより、正常組織と比べてpHが低下しており、特に悪性度の高いがん細胞が存在するといわれる低酸素領域では嫌気的代謝※9によってpHが大きく低下している。西山は、ナノマシン造影剤の投与によって、肝臓に転移したわずか1.5ミリメートルの微小ながんを極めて高感度でMRIにより検出でき、低酸素領域を、侵襲的な生体組織診断を行うことなく可視化できることを、マウスを使った実験で明らかにした。西山は「ナノマシン造影剤を用いれば、DDSのがんへの集積を事前に予測することができ、治療中に用いれば効果を迅速に判定することができるために、より確実なピンポイント治療が可能になります」と語る。ナノマシン技術が医療に革新をもたらしつつある。
ナノマシンを医療現場に応用するためには、医薬品としての規制に対する品質保証や製造容易性、製造コストを考える必要があることは言うまでもない。複雑なシステムでは、良い論文は書けるが、実用化は極めて困難なのが現状である。このようなジレンマに対して西山は、ナノマシンを構成する高分子には、できるだけシンプルな構造に高度な機能をもたせることが重要であると考え、新たな高分子材料の開発にも取り組んでいる。その一つが、2017年に開発した「トランスポーター※10密度を認識してがん細胞と選択的に相互作用する水溶性ポリマー※11」だ。
現在、がん細胞の標的化には、抗体※12が広く利用されている。抗体はがん細胞表面のがん抗原※13を認識するが、実際に利用できるがん抗原は限られており、万能ではない。また、がん組織では、がん抗原の発現量が少ないがん細胞が治療後に増殖し、がんが再発するリスクがある。一方で、がん細胞の生存に必要不可欠な物質も存在する。それらの物質を標的にすれば、あらゆるがん細胞を標的化できるものと考えられるが、そのような物質は正常細胞にも存在するため、がん細胞だけを狙い撃ちすることはできない。
そこで西山が着目したのが、がんの特異的な代謝だ。がんは代謝異常の疾患であると考えることができる。その特徴を利用し、がん細胞で活発化するグルコース代謝を可視化する「ポジトロン断層法(PET)イメージング」が、がんの診断に幅広く利用されている。
近年、グルコース代謝と同様に、グルタミン※14代謝もがん細胞に共通して活発化していることが明らかになっている。そこで、西山はこのグルタミン代謝に着目し、グルタミン構造を側鎖に有する高分子を開発した(図3)。
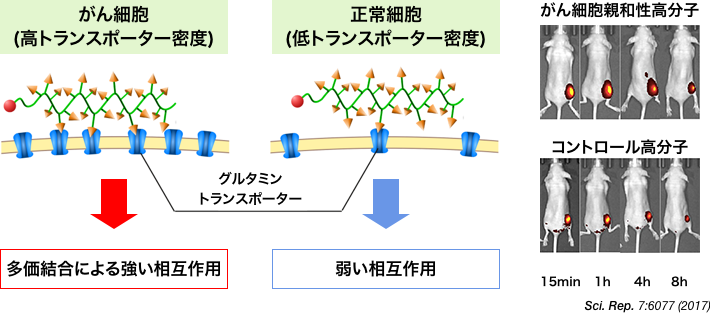
図3. がん細胞との親和性を有する、シェル(ナノマシンの外殻)構成高分子の開発
一般的に、グルタミンは「トランスポーター」を介して細胞内に取り込まれる。そこで西山は、高分子の側鎖にグルタミン構造を複数導入することで、がん細胞と相互作用する水溶性高分子を開発した。この高分子は、トランスポーター発現量が低い正常細胞とは相互作用せず、トランスポーター発現量が多いがん細胞と多価結合により強く相互作用する(図3)。つまり、この高分子は、トランスポーターの“密度”を認識して、がん細胞と特異的に結合する高分子であり、グルタミン代謝が活発化しているあらゆるがん細胞を狙い撃ちすることができるのだ。

このような設計は、タンパク質1分子を標的とする抗体では不可能であり、高分子を用いることの意義を示している。これまでナノマシンの外殻(抗がん剤や造影剤を包むカプセル)には、主に水溶性ポリマーであるポリエチレングリコール(PEG)が使われてきた。それに対し、西山は、この高分子は「がん細胞に対する親和性」という新たな機能を備えた水溶性ポリマーとして、PEGに代わるナノマシンの外殻になると考えている。「すなわち、スマート機能を付与した高分子の設計により、シンプルでありながら、高機能なナノマシンの実現が可能になるというわけです」と西山は語る。
これらの研究は最近の成果の一例であるが、西山は日本医療研究開発機構(AMED)や文部科学省の革新的イノベーション創出プログラム(COI STREAM)などのプロジェクトにおいて、核酸医薬のデリバリーのためのナノマシンや、医療機器とナノマシンの融合による超低侵襲治療システム(入院不要の日帰り治療システム)の開発など、未来医療の実現に向けた幅広い研究開発を展開している。
そんな西山が、旧・資源化学研究所※15の高分子材料研究部門に赴任してきたのは2013年のことだ。
「資源化学研究所は、高分子研究で古い歴史があり、『導電性高分子の発見と発展』により、2000年にノーベル化学賞を受賞された白川英樹博士がいらした研究所でもあります。そのため、その一員として研究室を主宰することにやりがいと責任を感じています。ナノマシンの研究には、合成、細胞、動物実験のすべてを行う必要がありますが、研究所の多大な支援によって、これらすべての実験を行うための環境を整備することができました。研究室の学生にとっても、最高の環境であると自負しています。私が抗がん剤の一種である『シスプラチン』のナノカプセルを開発したのは片岡先生の研究室に所属している大学院生の時です。それが今、臨床試験にまで進んでいます。私は大学院生とともに研究室での研究から、実際に医療現場で使えるものを開発したいと強く願っています。大学院生一人一人が『自分の力で多くの患者さんを救えるかもしれない』、『世の中の医療を変えることができるかもしれない』、そういう夢を持って研究をすることが大事なんです」と西山は語る。

とはいえ、研究開発は思い通りにいくことばかりとは限らない。それに対し、西山は最後にこう語った。「チャレンジ性の高い研究は失敗することの方が多いですが、白川先生の導電性高分子の研究も然り、多くの大発見は失敗を見逃さなかったことから生まれています。ですから、失敗を恐れずに、考えたことをとにかく実行に移すことが大事です。考えることは大事ですが、頭の中で研究を完結させてはいけないと思います。たとえ悪い結果であっても、予想外の結果が出てきた時が一番面白いんです。また、恩師の片岡先生からいただいた言葉に、『Never Never Never Give up!』があります。一度やると決めたことは決してあきらめるなということです。私はこれまで数え切れない失敗を繰り返してきましたが、そこから何かをつかみ取ってやるぞという強い気概で研究を続けてきましたし、これからも夢に向かって前進していく所存です。今後、研究を志す学生の皆さんにもあきらめないことの大切さを伝えていきたいですね」
分子量が大きい分子。天然高分子と合成高分子に分類される。合成高分子(ポリマー)は、特定の単位(モノマー)の繰り返し構造を有しており、化成品、自動車や電子機器等の部材からエネルギー、バイオまで幅広く利用されている。
分子量の小さい化合物。分子量は数千以下であるが、バイオ医薬品とは区別される。
天然および化学修飾型ヌクレオチドを基本骨格とする薬物。ヌクレオチド配列によってさまざまな標的に対する薬物を設計することができる。
低分子医薬品と異なり、生物を用いて製造、 抽出、半合成されたタンパク質、核酸等の医薬品。バイオテクノロジーの進歩によって、医薬品の主流となりつつある。
特定の分子と特異的に結合する核酸分子やペプチド。ランダム配列の巨大ライブラリ中から選び出すことができ、抗体に代わる分子として期待される。
抗体の構造内で、 抗原(異物)を認識する可変領域(Fv領域)を構成するL、H鎖由来の2本のペプチドをリンカーで繋いだ分子。抗体に代わる分子として期待される。
生体の免疫機能を担う標的に対して非常に高い特異性をもって結合する分子。バイオ医薬品の一つであり、抗がん剤市場の上位を占めるなど、医薬品の主流となっている。
ブドウ糖のこと。生体にとって最も重要なエネルギー源である。
酸素を使わないブドウ糖の代謝。エネルギー産生効率は低く、有機物が生成する。
細胞表面に存在する膜貫通型の輸送体。イオン、ブドウ糖、アミノ酸を細胞内外へと輸送する役割を担っている。
合成高分子(ポリマー)のうち、水溶性のもの。
生体の免疫機能を担う標的に対して非常に高い特異性をもって結合する分子。抗体は病原体を不活性化したり体内から除去する役割を持つ。
免疫ががん細胞として認識するためのタンパク質。乳がん細胞に存在するHER2などが知られている。
アミノ酸の一種。近年、がん細胞では、グルコース代謝と同様に、グルタミン代謝が注目されている。がん細胞は、グルタミンを多く取り込んで、細胞の生存に必須な脂肪酸、タンパク質、核酸を合成し、増殖している。
2016年4月、科学技術創成研究院 設置に伴い改組。

西山 伸宏(Nobuhiro Nishiyama)
科学技術創成研究院 化学生命科学研究所 教授
スペシャルトピックスでは本学の教育研究の取組や人物、ニュース、イベントなど旬な話題を定期的な読み物としてピックアップしています。SPECIAL TOPICS GALLERY から過去のすべての記事をご覧いただけます。
2018年1月掲載