研究
研究


今や2人に1人ががんを発症する時代。がんの治療法の一つに、手術でがんを切除する方法があるが、がんを肉眼で確認するのは難しい。そこで、がんを光らせることができる「蛍光プローブ」と呼ばれる物質の研究開発に取り組んでいるのが、生命理工学院 生命理工学系の神谷真子教授だ。最近では、識別できるがん細胞の種類を飛躍的に増やし得る「ラマンプローブ」の研究で世界をリードし、より精密ながん診断の実現を目指すとともに、生命現象の謎や病理の解明に迫っている。
-まず、神谷先生の研究内容を聞かせて下さい。
がんの三大標準治療法には、外科療法、放射線療法、化学療法があります。その中の外科療法は、がん組織を切除する方法です。外科療法では、残存するがん病変を可能な限り取り除くことで生存率が伸びるとされています。そのため、少し前までは、がん組織とその周辺組織を大きめに切除していました。しかし、この方法は正常な組織を切除することによる弊害や患者への負担が大きいことから、現在はがん組織を選択的に切除する方法の研究開発が進められています。

しかし、がん組織のみを切除することは容易なことではありません。手術前にがんの場所や大きさを検査して調べますが、手術中にどこにどれだけのがんが存在しているのかを肉眼で見つけ出すのは困難だからです。
そこで、手術中にがん細胞を光らせて可視化しようという「術中蛍光イメージング」の技術開発が行われるようになりました。つまり、蛍光物質を使ってがんなどの病変部位を光らせるというものです。それにより、外科手術でがん組織を効率良く切除できる上、切除漏れもなくなることが期待されます。
世界中でがん細胞を光らせる物質「蛍光プローブ」の開発が進められていますが、がんを光らせる蛍光プローブには、常に光っているタイプと、がん細胞に特徴的な分子と反応することで初めて光るタイプの2種類があります。後者を「アクチベータブル型」といいます。アクチベータブル型は、微小ながん病変であってもすぐに見つけ出すことができるというメリットがあるため、私たちはアクチベータブル型に特化して研究開発を進めています。

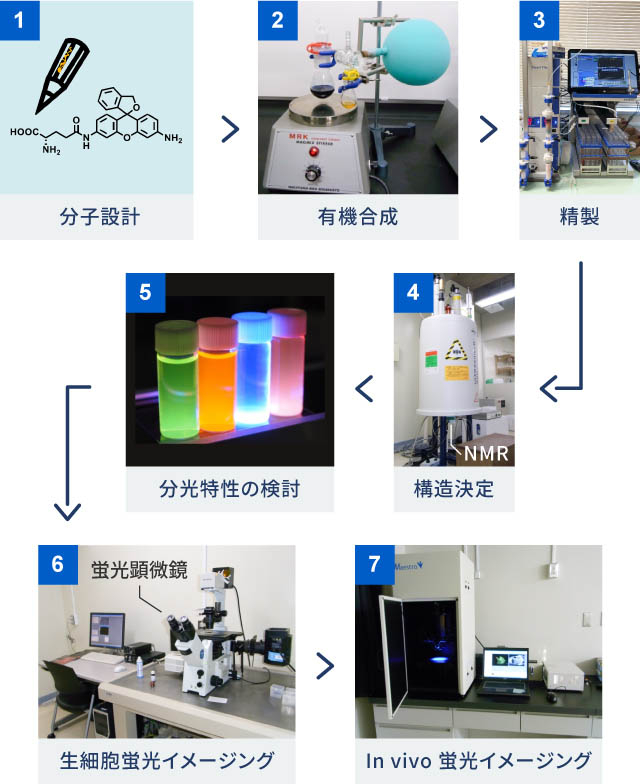
神谷研究室のプローブの研究開発の流れは次の通り。まず、目的に応じて、プローブの分子構造を設計する。次に、設計に基づき化合物を合成する。合成したものの中から、欲しい化合物だけを取り出す精製をする。さらに、目的の化合物ができているかを、核磁気共鳴装置(NMR)や質量分析装置(MS)を使って解析する。そして、目的通りの特性を有しているかを評価する。最後にがん細胞やがんモデルマウスなどに適用・投与してイメージングし確認する。このサイクルを何度も回しながら、目的の特性を持つ蛍光プローブを得る。
-神谷先生が研究開発を進めている蛍光プローブの特徴を聞かせて下さい。
私たちは、がん細胞が持つ “酵素”に着目し、その酵素と反応することによって初めて光る蛍光プローブの研究開発に取り組んできました。がんの酵素と反応する前までは、光を当てても光らないのですが、がんの酵素と反応すると瞬時に明るく光りだす特徴があるので、迅速にがんを光らせることができます。
このプロジェクトは、東京大学薬学系研究科の浦野泰照先生と多くのラボメンバーと一緒に進めてきたものですが、最初にがんモデルマウスにおけるがんがピカピカ光っている様子を肉眼で見たときには、「これはすごい技術になる!」と確信しました。
-蛍光プローブの研究開発ではどのような苦労がありましたか?
がんの種類によって持っている酵素が違うので、最適な蛍光プローブを探すのに苦労しました。まず蛍光プローブの種類を増やして、この中からがんで光るプローブの探索を行いました。その際、さまざまな診療科の臨床医の先生方にご協力いただきました。
探索の結果、有望な蛍光プローブが見つかり、患者さん由来の検体におけるがんを光らせることができた時の喜びはひとしおでした。

神谷研究室で導入している蛍光顕微鏡。「従来の蛍光顕微鏡とは異なり、暗室が不要な優れものです」と神谷教授。蛍光プローブでがん細胞が光るようにした細胞をセットすると、がん細胞が光っている様子を観察することができる。
-神谷先生が力を入れて取り組んでいる最新の研究を教えてください。

2018年頃からは蛍光プローブに加えて、「ラマンイメージング」で利用できるアクチベータブル型の「ラマンプローブ※」の研究開発にも着手しています。
ラマンイメージングとは、分子振動に由来するラマン信号を、光を使って観察しようというものです。光と分子の相互作用の一つであるラマン散乱を検出することで、分子の種類の特定や分子構造の解析ができます。
細胞内には、非常に多くの種類の分子が存在しており、それらが相互作用しながら機能しています。そのため、生命現象や病因を包括的に理解するには、より多くの種類の分子を同時に観察し相互作用を明らかにする必要があります。
蛍光イメージングは同時に検出できる分子の種類が4~5種類に限られるという課題があるのですが、ラマンイメージングは、同時に検出できる分子の種類が10種類以上と蛍光イメージングに比べて多いというメリットがあります。
ラマンプローブ:ラマンイメージングで用いられる化学プローブの総称。異なる分子振動周波数を有するラマンプローブを用いることで、複数の分子を同時に検出することが可能となる。
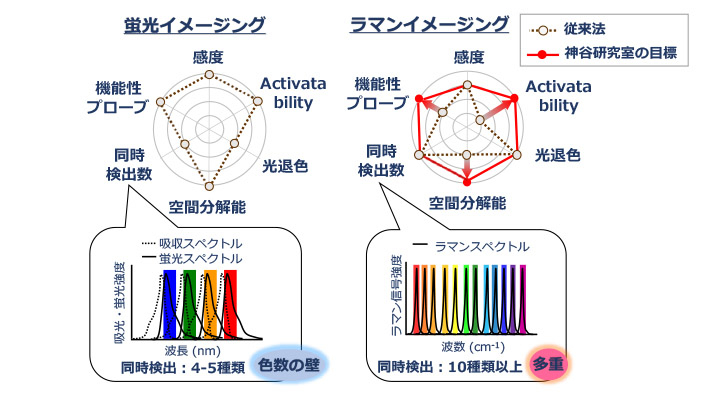
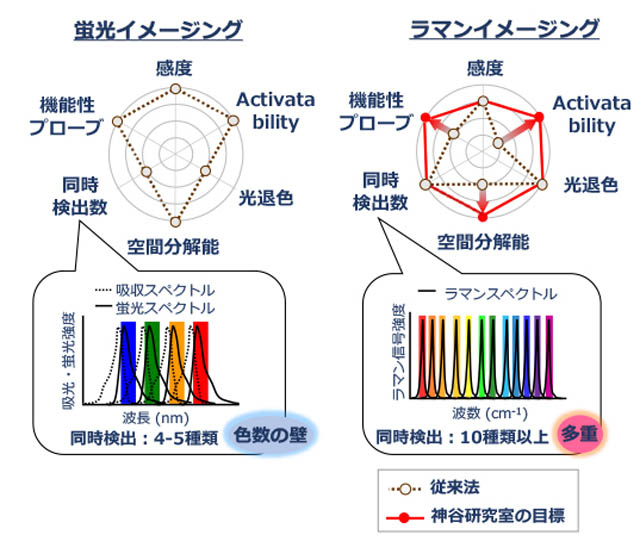
蛍光イメージングに比べてラマンイメージングの方が同時に検出できる分子の種類が多いというメリットがある。
-複数種類の分子を見られるということが重要なのですね。
がんの種類によって持っている酵素の種類や組み合わせが異なります。そこで、複数の酵素活性を検出できるラマンプローブを用いることで、より多くの酵素活性のパターンを観察できるようになれば、たとえば、より精密な診断ができるようになるのではないかと考えています。また、「この酵素活性のパターンならこの薬」といった具合に、がんの性質に合わせて、効果的な治療法の提案などもできるようになるかもしれません。

蛍光プローブやラマンプローブとなりうる化合物の精製を行う神谷教授
-ラマンイメージングにはどのような課題がありますか?
ラマンイメージングは、細胞内の特定の酵素などの分子と反応することで初めて光るアクチベータブル型のプローブの開発が進んでいないことが大きな課題でした。ラマン信号は分子振動に由来するものなのですが、分子振動の強弱を制御するのは難しいと考えられていたからです。
ところが、あることをきっかけに、もしかしたら、がん細胞が持つ酵素と反応して初めてラマン信号がオンになるアクチベータブル型のラマンプローブを開発できるかもしれないと思い、研究開発に着手することにしたのです。
2018年の夏に参加した研究会で、東京大学 先端科学技術研究センターの小関泰之教授が私の研究発表を聞き、声をかけてくれたのです。小関先生によれば、ラマンイメージングの分野で今、話題になっている論文があり、その論文に出ている化合物の構造が、私が開発した蛍光プローブの構造とよく似ているとのことでした。
私の蛍光プローブの設計をラマンイメージングに応用することで、アクチベータブル型のラマンプローブが実現できるのではないかということになり、小関先生と共同研究を開始したのです。
そして、2020年、アクチベータブル型のラマンプローブの開発に初めて成功しました。前例がないところからの挑戦であり、試行錯誤の連続でしたが、当研究室の藤岡礼任助教が主体的に取り組んでくれたおかげで、本プロジェクトを大きく前に進めることができました。
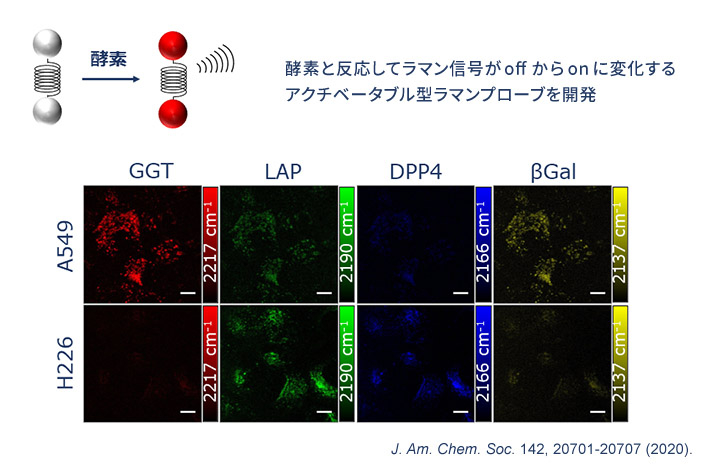
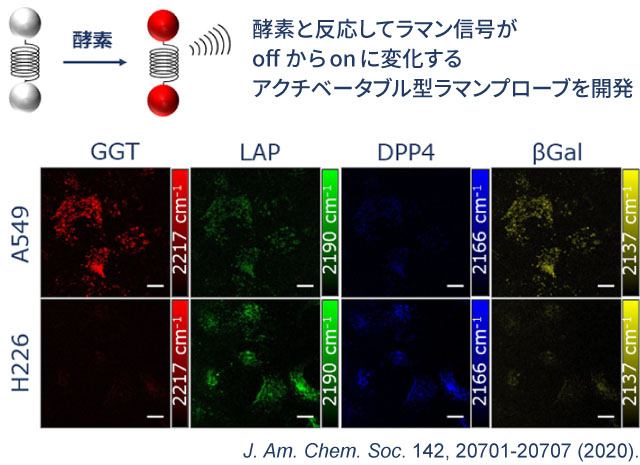
2020年、東京大学 先端科学技術研究センターの小関泰之教授との共同研究により、アクチベータブル型のラマンプローブの開発に初めて成功。ここでは、4種類のラマンプローブ(GGT、LAP、DPP4、βGal)を使って、2種類の肺がん(A549とH226)の酵素活性を見ている。このように、同時に観察できる酵素の種類や活性パターンが増えることで、より精密ながん診断ができるようになると期待される。
-革新的なプローブの開発を実現できた要因はどこにあると思われますか?

がん細胞が持つ酵素に反応してさまざまな色に光るラマンイメージング(デザインイラスト)
やはり新たな分野を開拓していこうと常にアンテナを張っていることだと思っています。特にアクチベータブル型のラマンプローブに関しては、常日頃から研究会に積極的に参加し、情報収集に努めてきたことや、自分の成果を発表してきたことが功を奏したと感じています。
-今後の目標を聞かせて下さい。
開発した蛍光プローブやラマンプローブを用いた診断法・イメージング法を実用化し、臨床や研究の現場に役立てたいです。生物学者や医師が本当によいと思えるものを作っていき、それにより生命現象の謎や病因の解明につなげられたら最高にうれしいですね。
-神谷先生がプローブの研究者になられた経緯を聞かせて下さい。

私は東京大学に入ったのですが、学部2年生の時に学部選択があり、いろいろな学部を見学する中、生物、化学、物理など複数の分野にまたがる薬学部にひかれ、薬学部を選びました。
さらに、学部4年生で研究室配属があり、そこで、蛍光プローブを研究している研究室(東京大学 薬学系研究科 薬品代謝化学教室 長野哲雄教授)を選びました。選んだ理由は研究室の見学に行った際、とても雰囲気が良かったことと生物学と化学の融合領域であることでした。研究室では、長野哲雄先生、浦野泰照先生にご指導いただき、よい先輩、後輩、仲間に恵まれ楽しい研究生活を送ることができました。
プローブの研究開発の面白さは、まず、自分の手で世界初の化合物を作る醍醐味(だいごみ)にあります。加えて、合成がうまくいけばピカピカ光る様子を観察できるというのも楽しみのひとつです。それにより、肉眼では見えなかったがん細胞が見えるようになるというのも感動の瞬間で、気付いたら研究者になっていました。
-研究者として大切にされている信条はありますか?
研究は決して1人ではできません。多くの方々に助けてもらっていることを常に忘れないようにしています。また、自己満足ではなく、ユーザーの視点や社会のニーズに積極的に耳を傾け、現場で実際に使えるものを作っていきたいと考えています。そのためにも周囲の方々との対話を大切にしています。
-最後に、研究者を目指す学生に向けてメッセージをお願いします。
日頃から学生には、勉強とは教科書を読む作業であり、一方、研究とは教科書を作っていく作業だとお伝えしています。研究とは、実験や観察を通して、これまで知らなかったことを明らかにする作業だということです。研究はうまくいかないことや大変なことの連続です。しかし、新しいことを発見した瞬間や、思い通りにいった瞬間の喜びはとても大きいものです。
とはいえ、研究の現場で何が行われているか想像しづらいと思います。
現在では、東工大をはじめ多くの大学でオープンキャンパスが実施されているので、興味のある研究があれば、ぜひそういった機会を利用して研究室を訪れていただき、研究者と直接話す機会を得てほしいと思います。


神谷真子
生命理工学院 生命理工学系 教授

「NEXT generation」は、社会の課題に対して次世代を担う若手研究者が取り組む最先端研究や、その未来社会へのインパクトを読者と共に考えていく新たなシリーズです。
マイクロプラスチックが生態系に与える影響を研究
(2022年12月掲載)
DNAから人工細胞や分子ロボットをつくる-物質と生命の境界を探求-
(2022年7月掲載)
「人とコンピュータ」の関係をデザイン -人間自身の理解につながる研究-
(2021年12月掲載)
エクソソーム研究でがん転移のメカニズム解明に挑む
(2021年5月掲載)
水害から人を守る
(2020年5月掲載)
伊藤亜紗准教授が考える“本当の多様性”とは
(2020年3月掲載)
“企業”と“大学”それぞれの道を歩む2人の若き研究者
(2019年10月掲載)
スペシャルトピックスでは本学の教育研究の取組や人物、ニュース、イベントなど旬な話題を定期的な読み物としてピックアップしています。SPECIAL TOPICS GALLERY から過去のすべての記事をご覧いただけます。
2023年6月掲載